Trong các axit sau đây: HCl, HF, HI, HBr, HNO3,H3PO4,H2S. Có bao nhiêu axit có thể điều chế được bằng cách cho tinh thể muối tương ứng tác dụng với H2SO4 đặc, nóng
A. 3
B. 4
C. 2
D. 5
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Axit HCl, HF, HI, HBr, HNO3,H3PO4,H2Schỉ có tính oxi hóa => không phản ứng ngược trở lại với H2SO4 . Nên có thể điều chế được bằng cách cho tinh thể muối của nó tác dụng với H2SO4 đặc, nóng.
Axit HI, HBr, H2S chứa ion I - , B r - và S 2 - có tính khử sẽ tác dụng ngược trở lại với H2SO4 , Do vậy không thể thu được HI, HBr và H2S

Chọn đáp án C
(a) Cho dung dịch KMnO4 tác dụng với dung dịch HF (đặc) thu được khí F2.
Sai
(b) Dùng phương pháp sunfat điều chế được: HF, HCl, HBr, HI.
Sai vì H2SO4 tác dụng với HBr và HI
(c) Amophot (hỗn hợp các muối NH4H2PO4 và (NH4)2HPO4) là phân phức hợp.
Đúng. Theo SGK lớp 11
(d) Trong phòng thí nghiệm, khí CO được điều chế bằng cách cho H2SO4 đặc vào axit fomic và đun nóng.
Đúng. Theo SGK lớp 11

Chọn đáp án C
(a) Cho dung dịch KMnO4 tác dụng với dung dịch HF (đặc) thu được khí F2.
Sai vì:
![]()
chỉ có với Clo, brom, Iot
(b) Dùng phương pháp sunfat điều chế được: HF, HCl, HBr, HI.
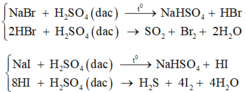
Sai vì H2SO4 tác dụng với HBr và HI
(c) Amophot (hỗn hợp các muối NH4H2PO4 và (NH4)2HPO4) là phân phức hợp.
Đúng. Theo SGK lớp 11
(d) Trong phòng thí nghiệm, khí CO được điều chế bằng cách cho H2SO4 đặc vào axit fomic và đun nóng.
Đúng. Theo SGK lớp 11

Chọn đáp án D
A. O3 có tính oxi hoá mạnh hơn O2.
Đúng. Theo SGK lớp 10
B. Muối AgI không tan trong nước, muối AgF tan trong nước.
Đúng. Theo SGK lớp 10
C. Na2CO3 là nguyên liệu quan trọng trong công nghiệp sản xuất thuỷ tinh.
Đúng. Theo SGK lớp 11
D. Các nguyên tố mà nguyên tử có 1, 2, 3, 4 electron lớp ngoài cùng đều là kim loại.
Sai. Ví dụ Hiđro có 1e lớp ngoài cùng nhưng là phi kim.

Chọn C
(d) Amophot (hỗn hợp các muối NH4H2PO4 và (NH4)2HPO4) là phân hỗn hợp.
(e) Trong phòng thí nghiệm, khí CO được điều chế bằng cách cho H2SO4 đặc vào axit fomic và đun nóng.

Điều chế HF, HCl bằng cách cho H 2 SO 4 đặc tác dụng với muối florua, clorua vì H 2 SO 4 à chất oxi hoá không đủ mạnh để oxi hoá được HF và HCl. Nói cách khác, HF và HCl có tính khử yếu, chúng không khử được H 2 SO 4 đặc
Ca F 2 + H 2 SO 4 → Ca SO 4 + 2HF
NaCl + H 2 SO 4 → NaH SO 4 + HCl
Nhưng không thể dùng phương pháp trên để điều chế HBr và HI vì H 2 SO 4 đặc oxi hoá được những chất này thành Br 2 và I 2 . Nói cách khác, HBr và HI là những chất có tính khử mạnh hơn HCl và HF.
NaBr + H 2 SO 4 → HBr + NaH SO 4
2HBr + H 2 SO 4 → Br 2 + SO 2 + 2 H 2 O
NaI + H 2 SO 4 → NaH SO 4 + HI
2HI + H 2 SO 4 → I 2 + SO 2 + 2 H 2 O

Cho các phát biểu sau
(1) Dãy HF, HCl, HBr, HI: độ bền tăng dần, tính axit và tính khử tăng dần.
(2) HF là axit yếu nhưng có tính chất đặc biệt ăn mòn thủy tinh.
(3) Phản ứng: NaX (tt) + H2SO4 đặc
(4) Các muối AgX đều là chất kết tủa (X là halogen).
(5) Không thể bảo quản axit HF trong chai, lo bằng thủy tinh.
(6) Trong nhóm halogen, theo chiều tăng dần điện tích hạt nhân: tính phi kim (tính oxy hóa) giảm dần còn tính khử tăng dần.
(7) Trong phòng thí nghiệm, có thể điều chế clo bằng cách cho HCl đặc tác dụng với các chất oxi hóa mạnh như MnO2, KMnO4, KClO3, K2Cr2O7,…
(8) Trong công nghiệp, điều chế clo bằng cách điện phân dung dịch natri clorua NaCl bão hòa (không có màng ngăn) .
Số phát biểu đúng là A. 2. B. 3. C. 4. D.5
Axit HCl, HF, HI, HBr, HNO3,H3PO4,H2Schỉ có tính oxi hóa → không phản ứng ngược trở lại với H2SO4 . Nên có thể điều chế được bằng cách cho tinh thể muối của nó tác dụng với H2SO4 đặc, nóng.
Axit HI, HBr, H2S chứa ion I - , Br - và S 2 - có tính khử sẽ tác dụng ngược trở lại với H2SO4 , Do vậy không thể thu được HI, HBr và H2S
Đáp án B