Cho 1,82 gam hỗn hợp bột X gồm Cu và Ag (tỉ lệ số mol tương ứng 4 : 1) vào 30 ml dung dịch gồm H2SO4 0,5M và HNO3 2M, sau khi các phản ứng xảy ra hoàn toàn, thu được a mol khí NO (sản phẩm khử duy nhất của N+5). Trộn a mol NO trên với 0,1 mol O2 thu được hỗn hợp khí Y. Cho toàn bộ Y tác dụng với H2O, thu được 150 ml dung dịch có pH = z. Giá trị của z là
A. 2.
B. 4.
C. 3.
D. 1.


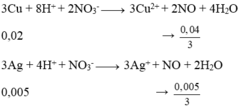
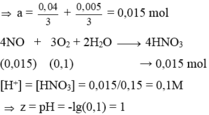


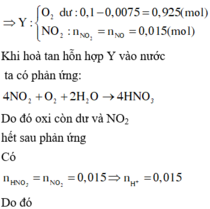
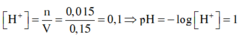

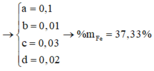
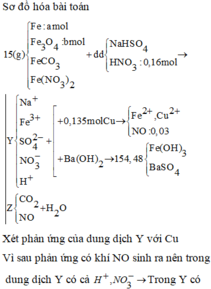


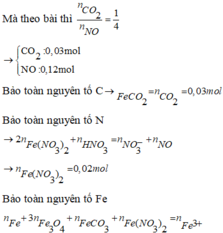

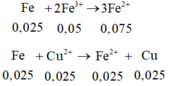
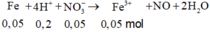
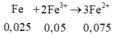
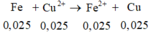
Gọi x = nAg → nCu = 4x → 64.4x + 108x = 1,82 → x = 0,005
nH2SO4 = 0,015 mol; nHNO3 = 0,06 mol → nH+ = 0,09 mol; nNO3- = 0,06 mol
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,02 → 0 , 04 3
3Ag + 4H+ + NO3- → 3Ag+ + NO + 2H2O
0,005 → 0 , 005 3
→ a = 0 , 04 3 + 0 , 005 3 = 0,015 mol
4NO + 3O2 + 2H2O → 4HNO3
(0,015) (0,1) → 0,015 mol
→ [H+] = [HNO3] = 0,015/0,15 = 0,1M → z = pH = -lg(0,1) = 1
Đáp án D