Cho hỗn hợp Al, Fe vào dung dịch HNO3 loãng, dư thu được 6,72 lít NO (là sản phẩm khử duy nhất của N+5 ở đktc). Số mol axit đã phản ứng là
A. 0,3 mol.
B. 0,6 mol.
C. 1,2 mol.
D. 2,4 mol.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
4HNO3 + 3e → NO + 3NO3– + 2H2O ⇒ nHNO3 = 4nNO = 1,2 mol

Đáp án B
Quy đổi hỗn hợp về Fe và O. Đặt nFe = a và nO = b
+ Vì HNO3 dư và nFe(NO3)3 = 0,4 mol ⇒ nFe = a = 0,4 mol
+ Áp dụng bảo toàn e ta có: 3nFe = 2nO + 3nNO
⇒ nO = 0,3 mol ⇒ m = 0,4×56 + 0,3×16 = 27,2 gam

3Cu+ 8H+ +2NO−3−−−>3Cu2+ + 2NO + H2O ( *)
0,3 ----- 1,8 ----- 1,2 -----------0,3-----0,2 --- mol
Cu2+ +2Fe2+−−−> 2Fe3+ +Cu
0,3 ------- 0,6 --------------------0,3
3Cu + 8H+ +2NO−3 −−−> 3Cu2+ +2NO + H2O ( ** )
0,3 ----- 1,8 ----- 1,2 -----------0,3-----0,2 --- molTừ (*) và (**) ==> n NO = 0,4 mol
=> V = 8,96 mol
=> Đáp án B

Đáp án C
* Sơ đồ quá trình phản ứng:
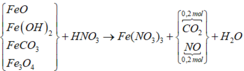
Giải hỗn hợp khí gồm 0,2 mol NO và 0,2 mol CO2.
Tất cả các chất trong m gam hỗn hợp (gọi là hỗn hợp X) đều cho đúng 1 electron
→ Bảo toàn electron ta có nX = 3nNO = 0,6 mol.
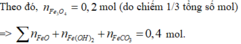
Dựa vào sự đặc biệt của nguyên tố Fe trong hỗn hợp ta có
![]()
Ban bật sơ đồ có 1,0 mol Fe(NO3)3
→ số mol HNO3 = 1,0 × 3 + 0,2 = 3,2 mol (bảo toàn nguyên tố N).
Đáp án C
4HNO3 + 3e → NO + 3NO3– + 2H2O
⇒ nHNO3 = 4nNO = 1,2 mol