Cho dd X gồm: 0,007 mol Na+; 0,003 mol Ca2+; 0,006 mol Cl–; 0,006 mol HCO3– và 0,001 mol NO3-. Để loại bỏ hết Ca2+ trong X cần một lượng vừa đủ dd chứa a gam Ca(OH)2. Giá trị của a là
A. 0,180.
B. 0,120
C. 0,444.
D. 0,222.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Đặt nCa(OH)2 = x
OH- + HCO3- → CO32- + H2O
2x → 2x → 2x (mol)
n Ca2+ = 0,003 + x; n CO32- = 2x
Loại hết Ca2+ thì Ca2+ phải kết tủa hết với CO32-
⇒ n Ca2+ = n CO32- ⇒ 0,003 + x = 2x ⇒ x = 0,003 ( thỏa mãn )
⇒ a = 0,222g

Đáp án A
Gọi x là số mol Ca(OH)2 cần dùng
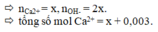
OH - + HCO3- → CO32- + H2O
2x 2x
Ca2+ + CO32-→ CaCO3
Để loại bỏ hết ion Ca2+ thì nCa2+ = nCO3(2-)

\(\text{Quy đổi hỗn hợp gồm : Na , Ca , O }\)
\(n_{Na}=n_{NaOH}=0.4\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0.25\left(mol\right)\)
\(m_O=23.2-0.4\cdot23-0.25\cdot40=4\left(g\right)\)
\(n_O=\dfrac{4}{16}=0.25\left(mol\right)\)
\(Na\rightarrow Na^++1e\)
\(Ca\rightarrow Ca^{+2}+2e\)
\(O+2e\rightarrow O^{2-}\)
\(2H^{+1}+2e\rightarrow H_2^0\)
\(\text{Bảo toàn electron : }\)
\(n_{Na}+2n_{Ca}=2n_O+2n_{H_2}\)
\(\Rightarrow0.4+2\cdot0.25=2\cdot0.25+2\cdot n_{H_2}\)
\(\Rightarrow n_{H_2}=0.2\left(mol\right)\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
Đáp án D
Đặt nCa(OH)2 = x
OH- + HCO3- → CO32- + H2O
2x → 2x → 2x (mol)
n Ca2+ = 0,003 + x; n CO32- = 2x
Loại hết Ca2+ thì Ca2+ phải kết tủa hết với CO32-
⇒ n Ca2+ = n CO32- ⇒ 0,003 + x = 2x ⇒ x = 0,003 ( thỏa mãn )
⇒ a = 0,222g