Cho 4,8g S tan hết trong 100g HNO3 63% được NO2 là sản phẩm khử duy nhất và dung dịch X . Dung dịch X có thể hoà tan hết tối đa bao nhiêu gam Cu biết sản phẩm khử của N+5 là N+2 :
A. 9,6g
B. 2,4g
C. 12,8g
D. 6,4g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

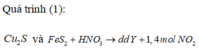
Vì thế Cu và Y vẫn có NO thoát ra
→ chứng tỏ H N O 3 dư
→ chứng tỏ phản úng oxi hóa – khử (1) xảy ra hoàn toàn.
→ khối lượng 12,8 kết hợp bảo toàn electron:
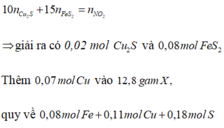
Phản ứng
a m o l H N O 3 → m u ố i F e 2 + ; C u 2 + ; S O 4 2 - ; N O 3 - + 1 , 4 m o l N O 2 + ? m o l N O

Đáp án là B

Đáp án B
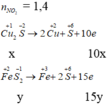
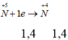
Ta có hpt: 160x + 120y = 12,8
10x + 15y = 1,4
=> x= 0,02, y= 0,08
DD Y: CuSO4 =2x = 0,04 Fe2(SO4)3 =0,5y = 0,04
H2SO4 = x+2y – 2x –3.0,5y = 0,02 ( bảo toàn nguyên tố S)
HNO3 dư
nCu= 0,07
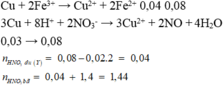

Đáp án B
Theo giả thiết và áp dụng bảo toàn electron cho phản ứng của X với HNO3, ta có :
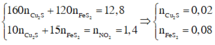
Dung dịch Y gồm Fe3+, Cu2+, SO 4 2 - , NO 3 - , H+. Khi cho Cu (tối đa) vào Y, Cu bị oxi hóa bởi (H+, NO 3 - ) và Fe3+. Vậy bản chất của bài toán là: Hỗn hợp Cu2S, FeS2 và Cu tác dụng với dung dịch HNO3, giải phóng hỗn hợp khí NO, NO2 và tạo ra dung dịch Z. Dung dịch Z có các ion Fe2+, Cu2+, SO 4 2 - , ion còn lại là H+ hoặc NO 3 - . Vì
![]()
nên ion còn lại trong dung dịch Z là ion âm để cân bằng điện tích, đó là ion NO 3 - .
Áp dụng bảo toàn electron và bảo toàn điện tích trong dung dịch Z và bảo toàn nguyên tố N, ta có :
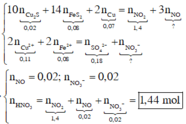

Đáp án B
Vì phản ứng chỉ thu được một khí duy nhất và sản phẩm khử duy nhất là khí NO nên sản phẩm trong phản ứng tương ứng với S trong FeS2 là S O 4 2 - tồn tại trong dung dịch.
Có phản ứng xảy ra như sau:
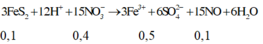
Khi đó dung dịch thu được chứa 0,1 mol Fe3+, 0,4 mol H+ và 0,3 mol N O 3 -
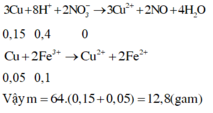
nS = 0,15
nHNO3 = 1 mol
S + 4H+ + 6NO3- → SO42- + 6NO2 + 2H2O
0,15 → 0,6 0,9
nH+ dư = 1 – 0,6 = 0,4
nNO3- dư = 1 – 0,9 = 0,1
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,15 0,4 ← 0,1 mol
⇒ mCu = 0,15.64 = 9,6g
Đáp án A.