Nung 200 gam hỗn hợp X gồm N a 2 C O 3 và N a H C O 3 cho đến khối lượng không đổi thấy khối lượng chất rắn giảm đi 62 gam. Phần trăm khối lượng mỗi chất trong X lần lượt là
A. 37% và 63%.
B. 21% và 79%.
C. 42% và 58%.
D. 16% và 84%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

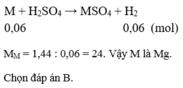

Gọi $n_{KMnO_4} = a(mol) ; n_{KClO_3} = b(mol) \Rightarrow 158a + 122,5b = 49,975(1)$
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
$2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
$m_{O_2} = m_{giảm} = 4(gam)$
$\Rightarrow n_{O_2} = 0,5a + 1,5b = \dfrac{4}{32} = 0,125(2)$
Từ (1)(2) suy ra a = 0,339 ; b = -0,029 < 0
(Sai đề)

Gọi số mol KMnO4, KClO3 là a, b
=> 158a + 122,5b = 49,975
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
_______a----------------------------------->a
2KClO3 --to--> 2KCl + 3O2
_b---------------------->1,5b
mO2 = mgiảm = 10,4
=> \(n_{O_2}=\dfrac{10,4}{32}=0,325\left(mol\right)\)
=> 0,5a + 1,5b = 0,325
=> a = 0,2; b = 0,15
=> \(\left\{{}\begin{matrix}\%KMnO_4=\dfrac{0,2.158}{49,975}.100\%=63,23\%\\\%KClO_3=\dfrac{0,15.122,5}{49,975}.100\%=36,77\%\end{matrix}\right.\)

Gọi số mol KMnO4, KClO3 là a, b
=> 158a + 122,5b = 49,975
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
2KClO3 --to--> 2KCl + 3O2
mO2 = mgiảm = 10,4
=> \(n_{O_2}=\dfrac{10,4}{32}=0,325\left(mol\right)\)
=> 0,5a + 1,5b = 0,325
=> a = 0,2; b = 0,15
=> \(\left\{{}\begin{matrix}\%KMnO_4=\dfrac{0,2.158}{49,975}.100\%=63,23\%\\\%KClO_3=\dfrac{0,15.122,5}{49,975}.100\%=36,77\%\end{matrix}\right.\)

Đáp án C
Ta có ![]()
![]()
=> mcác kim loại = ![]()
Chuỗi phản ứng: ![]()
![]()
![]()
![]()
=> nO oxi hóa FeO thành Fe2O3 =1,57 - 1,37 = 0,2 mol
Phản ứng: ![]()
= 0,2.2 = 0,4 mol
![]()
![]()

MgCO3 \(\underrightarrow{to}\) MgO + CO2 (1)
CaCO3 \(\underrightarrow{to}\) CaO + CO2 (1)
Theo định luật bảo toàn khối lượng:
\(m_{hhA}=m_{cr}+m_{CO_2}\)
\(\Rightarrow m_{CO_2}=m_{hhA}-m_{cr}=73,8-40,8=33\left(g\right)\)
\(\Rightarrow n_{CO_2}=\dfrac{33}{44}=0,75\left(mol\right)\)
Gọi \(x,y\) lần lượt là số mol của MgCO3 và CaCO3
Theo PT1: \(n_{CO_2}=n_{MgCO_3}=x\left(mol\right)\)
Theo PT2: \(n_{CO_2}=n_{CaCO_3}=y\left(mol\right)\)
Ta có: \(\left\{{}\begin{matrix}84x+100y=73,8\\x+y=0,75\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,075\\y=0,675\end{matrix}\right.\)
Vậy \(n_{MgCO_3}=0,075\left(mol\right)\) ; \(n_{CaCO_3}=0,675\left(mol\right)\)
\(\Rightarrow m_{MgCO_3}=0,075\times84=6,3\left(g\right)\) \(\Rightarrow\%m_{MgCO_3}=\dfrac{6,3}{73,8}\times100\%=8,54\%\)
\(m_{CaCO_3}=0,675\times100=67,5\left(g\right)\Rightarrow\%m_{CaCO_3}=\dfrac{67,5}{73,8}\times100\%=91,46\%\)