Khi nhỏ từ từ đến dư dung dịch HCl dung dịch hỗn hợp gồm x mol Ba(OH)2 và y mol Ba(AlO2)2, kết quả thí nghiệm được biểu diễn trên đồ thị bên.
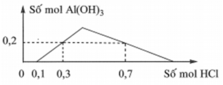
Giá trị của x và y lần lượt là
A. 0,05 và 0,15
B. 0,10 và 0,30
C. 0,10 và 0,15
D. 0,05 và 0,30
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Phân tích đồ thị: – Đoạn ngang (1): H+ + OH– → H2O.
– Đoạn xiên lên (2): H+ + AlO2 + H2O → Al(OH)3.
– Đoạn xiên xuống (3): 3H+ + Al(OH)3 → Al3+ + 3H2O.
Áp dụng: – Xét đoạn (1): nOH– = 0,1 mol ⇒ x = 0,05 mol.
– Xét đoạn (3): ta có công thức: nH+ = 4nAlO2– – 3n↓.
(số mol H+ này chỉ tính phần H+ phản ứng với AlO2–)
⇒ nAlO2– = (0,6 + 0,2 × 3) ÷ 4 = 0,3 mol ⇒ y = 0,15 mol

Giải thích:
Từ đồ thị ta thấy số mol HCl bắt đầu 0,1 mol mới xuất hiện kết tủa
=> 0,1 mol HCl dùng để trung hòa Ba(OH)2
=> nOH- = nH+ = 0,1 (mol) => nBa(OH)2 = 1/2nOH- = 0,05 (mol) = a
Ta thấy tại giá trị nHCl = 0,3 và 0, 7 mol đều thu được lượng kết tủa như nhau Al(OH)3: 0,2 (mol)
=> Tại nHCl = 0,7 mol thì lượng kết tủa Al(OH) đã đạt cực đại, sau đó bị hòa tan đến khi còn 0, 2 mol
Áp dung công thức nhanh ta có:
nH+ = 4nAlO2 – 3nAl(OH)3 + nOH-
=>0, 7 = 4. 2b – 3. 0,2 + 0,1
=> b = 0,15 (mol)
Vậy a: b = 0,05: 0,15 = 1: 3
Đáp án A

Chọn A
Từ đồ thị ta thấy số mol HCl bắt đầu 0,1 mol mới xuất hiện kết tủa
=> 0,1 mol HCl dùng để trung hòa Ba(OH)2
=> nOH- = nH+ = 0,1 (mol) => nBa(OH)2 = 1/2nOH- = 0,05 (mol) = a
Ta thấy tại giá trị nHCl = 0,3 và 0, 7 mol đều thu được lượng kết tủa như nhau Al(OH)3: 0,2 (mol)
=> Tại nHCl = 0,7 mol thì lượng kết tủa Al(OH) đã đạt cực đại, sau đó bị hòa tan đến khi còn 0, 2 mol
Áp dung công thức nhanh ta có:
nH+ = 4nAlO2 – 3nAl(OH)3 + nOH-
=>0, 7 = 4. 2b – 3. 0,2 + 0,1
=> b = 0,15 (mol)
Vậy a: b = 0,05: 0,15 = 1: 3

Đáp án A
Từ đồ thị ta thấy số mol HCl bắt đầu 0,1 mol mới xuất hiện kết tủa
=> 0,1 mol HCl dùng để trung hòa Ba(OH)2
=> nOH- = nH+ = 0,1 (mol) => nBa(OH)2 = 1/2nOH- = 0,05 (mol) = a
Ta thấy tại giá trị nHCl = 0,3 và 0, 7 mol đều thu được lượng kết tủa như nhau Al(OH)3: 0,2 (mol)
=> Tại nHCl = 0,7 mol thì lượng kết tủa Al(OH) đã đạt cực đại, sau đó bị hòa tan đến khi còn 0, 2 mol
Áp dung công thức nhanh ta có:
nH+ = 4nAlO2 – 3nAl(OH)3 + nOH-
=>0, 7 = 4. 2b – 3. 0,2 + 0,1
=> b = 0,15 (mol)
Vậy a: b = 0,05: 0,15 = 1: 3

Đáp án C
TN1 : Nhỏ từ từ HCl vào hỗn hợp x mol NaOH và y mol Na2ZnO2 ta thấy tới 0,1 mol HCl mới thấy xuất hiện kết tủa. Do vậy 0,1 mol HCl này dùng để trung hoà NaOH →x=0,1.
Khi dùng 0,3 mol HCl thì thu được 0,05 mol kết tủa Zn(OH)2 và đồ thị đang đi xuống tức đang hoà tan kết tủa.
Để toạ thành kết tủa lúc đồ thị đi lên thì cần 0,1 +0,05.2=0,2 mol HCl.
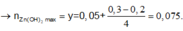
TN2 : Cho HCl vào z mol Ba(OH)2 và t mol Ba(AlO2)2.
Khi dùng tới 0,3 mol HCl mới chỉ xuất hiện 0,05 mol kết tủa Al(OH)3 trong lúc đang tạo kết tủa.
Do vậy
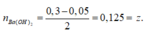
Khi dùng 0,3 hay 0,5 mol đều thu được 0,05 mol kết tủa

=> t = 0,05
Đáp án A
► Phân tích đồ thị: – Đoạn ngang (1): H+ + OH– → H2O.
– Đoạn xiên lên (2): H+ + AlO2 + H2O → Al(OH)3.
– Đoạn xiên xuống (3): 3H+ + Al(OH)3 → Al3+ + 3H2O.
► Áp dụng: – Xét đoạn (1): nOH– = 0,1 mol ⇒ x = 0,05 mol.
– Xét đoạn (3): ta có công thức: nH+ = 4nAlO2– – 3n↓.
(số mol H+ này chỉ tính phần H+ phản ứng với AlO2–)
||⇒ nAlO2– = (0,6 + 0,2 × 3) ÷ 4 = 0,3 mol ⇒ y = 0,15 mol