Hòa tan hết 14,8 gam hỗn hợp Fe và Cu vào 126 gam dung dịch H N O 3 48% thu được dung dịch X (không chứa muối amoni ). Cho X phản ứng với 400 ml dung dịch NaOH 1M và KOH 0,5M thu được kết tủa Y và dung dịch Z. Nung Y trong không khí đến khối lượng không đổi thu được 20 gam CuO và F e 2 O 3 . Cô cạn dung dịch Z, thu được chất rắn khan T. Nung T trong không khí đến khối lượng không đổi thu được 42,86 gam hỗn hợp chất rắn. Nồng độ phần trăm của F e N O 3 3 trong X có giá trị gần nhất với giá trị nào sau đây ?
A. 8,2
B. 7,9
C. 7,6
D. 6,9

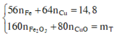
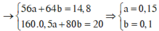
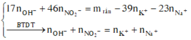

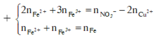
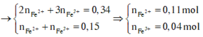
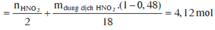

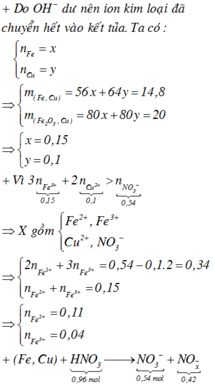
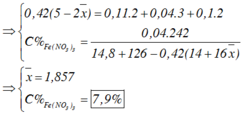
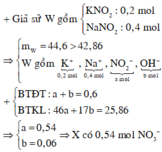
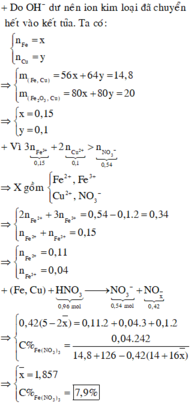
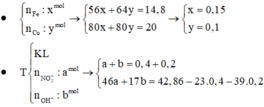
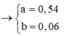

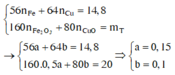
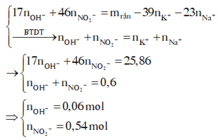
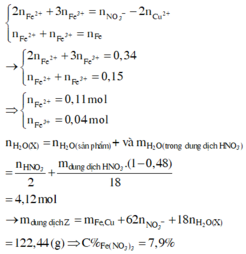
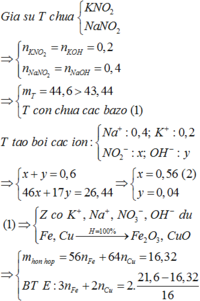
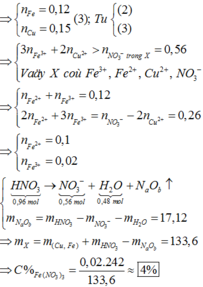
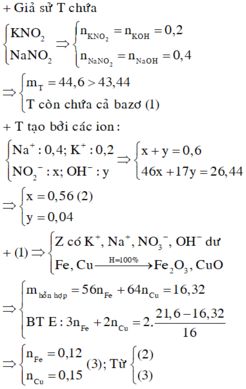
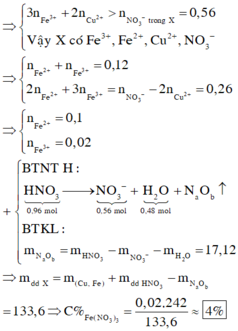
Đáp án B
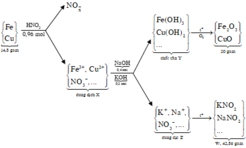
n H N O 3 = 0,96 mol và n N a O H = 0,4 mol, n K O H = 0,2
đặt n F e = x mol và n C u = y mol
Bảo toàn nguyên tố có n F e 2 O 3 = ½ . n F e = ½ .x
n C u O = n C u = y
Ta có hệ phương trình sau 56x + 64 y = 14,8 gam và 80x + 80y = 20
→ x = 0,15 mol và y = 0,1 mol
Nếu dung dịch Z chỉ chứa 2 muối N a N O 3 và K N O 3 thì khi đun nóng thu được K N O 2 và N a N O 2
Bảo toàn nguyên tố có n N a N O 2 = n N a O H = 0,4 và n K O H = 0,2 = n K N O 2
→ mrắn = 0,4.69 +0,2. 85 = 44,6 gam > 42,86 nên Z còn chứa cả NaOH và KOH
Z chứa : N a + : 0,4 mol; K + : 0,2 mol; OH- : a mol và N O 3 - : b mol
Bảo toàn điện tích có 0,4 + 0,2 = a + b (*)
Đun nóng Z có 0,4 mol Na ; K + : 0 , 2 m o l ; O H - : a m o l v à N O 2 - : b m o l
→ 17a + 46b + 0,2.39 + 0,4.23 = 42,86 (**)
Từ (*) và (**) → a = 0,06 và b = 0,54
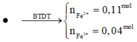
→ dd X chứa F e 2 + : c m o l ; F e 3 + : d m o l v à C u 2 + : 0 , 1 m o l ; N O 3 - : 0 , 54 m o l (cùng bằng lượng NO3- trong Z)
Bảo toàn điện tích có 2c + 3d + 0,1.2 = 0,54 (***)
Bảo toàn Fe có c + d =0,15 (****)
Từ (***) và (****) → c = 0,11 và d =0,04 mol
Bảo toàn nguyên tố có n N (sp khử) = n H N O 3 – n N O 3 (Y) = 0,96 – 0,54 =0,42 mol
Quy đổi khí sản phẩm khử là N : 0,42 mol và O : e mol
Bảo toàn e có 2 n F e ( 2 + ) + 3 n F e ( 3 + ) + 2 n C u ( 2 + ) - 2 n O = 5 n N
→ 5.0,42 = 2.0,11 +3.0,04 + 0,1.2 +2e
→ e = 0,78 mol
Bảo toàn khối lượng mdd X = m K L + m H N O 3 – m N – m O
= 14,8 + 126 – 0,42.14 – 0,78.16 =122,44 g
Nồng độ % của F e N O 3 3 là := 7,9%