Cho lượng dư dung dịch AgNO3 vào dung dịch hỗn hợp gồm 0,1 mol NaF và 0,1 mol NaCl. Khối lượng kết tủa tạo thành là
A. 14,35 g
B. 10,8 g
C. 21,6 g
D. 27,05 g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

| AgNO3 | + | NaCl | → | AgCl | + | NaNO3 |
\(n_{AgCl}=n_{NaCl}=0,1\) (mol)
=> \(m_{AgCl}=n.M=0,1.\left(108+35,5\right)=14,35\)(g)
Ta được kết quả là đáp án A

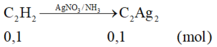
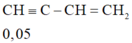
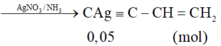
- Khối lượng kết tủa = 0,1 . 240 + 0,05.159 = 31,95 gam.
- Chọn đáp án D.

Sau phản ứng dung dịch chứa 0,1 mol $Cu^{2+}$ và 0,3 mol $Fe^{2+}$
Bảo toàn điện tích ta có: $n_{Cl^-}=0,8(mol)$
Phản ứng với AgNO3 thì thu được 0,8 mol $AgCl$ và 0,3 mol $Ag$
$\Rightarrow a=147,2(g)$
Lượng HCl vừa đủ hòa tan Fe3O4 ⇒nHCl=8nFe3O4=0,8(mol)⇒nHCl=8nFe3O4=0,8(mol)
Sau phản ứng sinh ra 0,1 mol FeCl2 và 0,2 mol FeCl3
0,2 mol FeCl3 hòa tan vừa hết 0,1 mol Cu
+)
Cho AgNO3 vào dd X thì xảy ra phản ứng đẩy kim loại trong muối tạo Ag và phản ứng tạo kết tủa AgCl
Bảo toàn e, ta có: nAg↓=2nCu+nFe3O4=0,3(mol)nAg↓=2nCu+nFe3O4=0,3(mol)
Bảo toàn nguyên tố, ta có: nAgCl↓=nHCl=0,8(mol)nAgCl↓=nHCl=0,8(mol)
Vậy khối lượng kết tủa sau cùng là:
m↓=108nAg↓+143,5nAgCl↓=147,2(g)

1.
Ta có PT
AgNO3 + NaF ---> không xảy ra pư
AgNO3 + NaCl ---> AgCl↓ + NaNO3
.0,1............0,1.............0,1
=>m\(AgCl\)= 143,5.0,1 = 14,35(g)
Chỉ có NaCl phản ứng
đáp án A