Hỗn hợp E gồm một axít cacboxylic no, hai chức (có phần trăm khối lượng cacbon lớn hơn 30%) và hai ancol X, Y đồng đẳng kế tiếp (MX<MY). Đốt cháy hoàn toàn 0,2 mol E cần vừa đủ 8,96 lít khí O2 (đktc) thu được 15,4 gam CO2 và 8,1 gam H2O. Đun nóng 0,2 mol E với axit sunfuric đặc thu được m gam các hợp chất có chức este . Biết phầm trăm số mol tham gia phản ứng este hóa của X và Y tương ứng bằng 30% và 20%.
Giá trị lớn nhất của m là
A. 6,32
B. 6,18
C. 4,86
D. 2,78

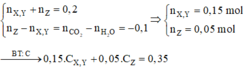
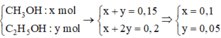
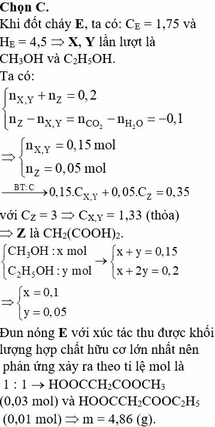


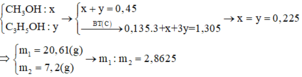
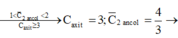
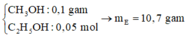
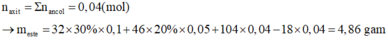
Đáp án D
nCO2=0,35 mol; nH2O=0,45 mol
nH2O>nCO2=> X, Y là ancol no.
BTNT O: nO(E)=2nCO2+nH2O-2nO2=0,35 mol => Số O trung bình trong E là 0,35/0,2=1,75
=>X, Y là ancol no,đơn chức, mạch hở
Số C trung bình là 0,35/0,2=1,75
=> 2 ancol là CH3OH và C2H5OH
E gồm:
CH4O: a
C2H6O:b
CnH2n-2O4:c
a+b+c=0,2
a+b+4c=nO=0,35
a+2b+nc=nC=0,35
=>c=0,05; a+b=0,15
=> b=0,2-0,05n>0=>n<4. Mặt khác: %mC=12n/(14n+62)=>n>2,4
=>n=3 CH2(COOH)2
=>a=0,1; b=0,05
Vậy E gồm:
CH4O: 0,1
C2H6O: 0,05
CH2(COOH)2: 0,05
nCH4Opu+nC2H6Opu=nH2O=0,1.30/100+0,05.20/100=0,04 mol
=>maxit pu=0,02 mol
BTKL: meste = m ancol pu + maxit pu -mH2O=0,03.32+0,01.46+0,02.104-0,04.18=2,78gam