Cho ba mẫu Mg nguyên chất có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch H2SO4 loãng (dư, cùng nồng độ, ở điều kiện thường). Thời gian để Mg tan hết trong ba cốc tương ứng là t 1 , t 2 , t 3 giây. So sánh nào sau đây đúng
![]()
![]()
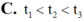
![]()


