Tiến hành điện phân dung dịch chứa Cu(NO3)2 1,2M và KCl 0,4M bằng điện cực trơ với cường độ dòng điện không đổi I = 5A trong 6176 giây thì dừng điện phân, khối lượng dung dịch giảm 15 gam. Cho 0,25 mol Fe vào dung dịch sau điện phân, kết thúc phản ứng thấy khí NO thoát ra (sản phẩm khử duy nhất của N+5) đồng thời thu được m gam hỗn hợp rắn. giá trị m là
A. 6,4
B. 9,6
C. 10,8
D. 7,6

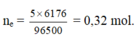



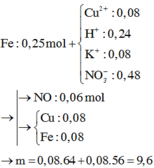
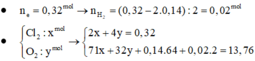
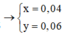
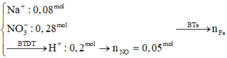
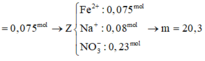
Chọn đáp án B.
Dung dịch điện phân chứa 3x mol Cu(NO3)2 và x mol KCl.
Áp dụng định luật điện phân Faraday, ta có ne trao đổi = It : 96500 = 0,32 mol.
Dung dịch điện phân ra x mol CuCl2 và y mol CuO. Ta có: 2x + 2y = 0,32 mol và 135x + 80y = 15 gam
Giải hệ được x = 0,04 mol và y = 0,12 mol
→ dung dịch sau điện phân có Cu(NO3)2; KNO3 và HNO3.
Bảo toàn nguyên tố H có nH2O = 0,12 mol → bảo toàn nguyên tố O có nNO = 0,06 mol.
Tiếp tục bảo toàn N suy ra số mol Fe(NO3)2 là 0,17 mol. Bảo toàn khối lượng kim loại ta có:0,25 x 56 + 0,08 x 64 = 0,17 x 56 + m → m = 9,6 gam