Cần m gam Ba(OH)2 để pha chế 250 ml dung dịch có pH=11. Giá trị của m gần nhất với?
A. 0,01 gam
B. 0,02 gam
C. 0,03 gam
D. 0,04 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khi pH = 10 thì [H+] = 1.10-10M và
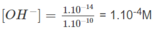
nghĩa là cần có 1. 10 - 4 mol NaOH trong 1 lít dung dịch.
Vậy trong 250 ml (0,25 lít) dung dịch cần có 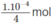 NaOH hoà tan, nghĩa là cần có
NaOH hoà tan, nghĩa là cần có
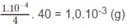 NaOH
NaOH

Đặt khối lượng kim loại trong hỗn hợp ban đầu là m gam; số mol O trong hoonx hợp ban đầu là a mol; số mol H2SO4 là b mol.
![]()
Sơ đồ phản ứng:
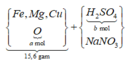
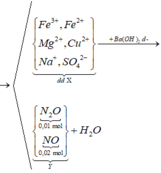
![]()
![]()
Các quá trình tham gia phản ứng của H+: 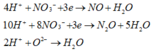
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
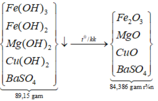
*Xét giai đoạn nung kết tủa đến khối lượng không đổi:
Sơ đồ phản ứng:
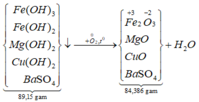
![]()
![]()
![]()
![]()
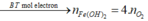
![]()
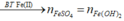
![]()
![]()
![]()
![]() = 85%.
= 85%.
Đáp án A.


Câu 2: Hòa tan 6,2 gam natri oxit vào 193,8 gam nước được dung dịch A. Cho A tác dụng với 300 gam dung dịch CuSO4 16%. Lọc kết tủa, rửa sạch, đem nung đến khối lượng không đổi, thu được m gam chất rắn màu đen. Giá trị của m là:
A. 29,4 gam B. 14,7 gam C. 9,8 gam D. 19,6 gam
giải thích
Na2O+H2O→2NaOH
0,1____ 0,1____0,2
2NaOH+CuSO4->Na2SO4+Cu(OH)2
0,2______ 0,1______ 0,1_____0,1
.mCu(OH)2=0,1.98=9,8(g)
câu 4
Câu 4: Để trung hoà 200ml hỗn hợp chứa HCl 0,3M và H2SO4 0,1M cần dùng V (ml) dung dịch Ba(OH)2 0,2M. Giá trị của V là: A. 250 ml B. 400 ml C. 350 ml D. 300ml
giải thích
Ba(OH)2 + 2HCl →→BaCl2 + 2H2O (1)
Ba(OH)2 + H2SO4 →→BaSO4 + 2H2O (2)
nHCl=0,2.0,3=0,06(mol)
nH2SO4=0,2.0,1=0,02(mol)
Theo PTHH 1 và 2 ta có:
1212nHCl=nBa(OH)2=0,03(mol)
nBa(OH)2=nH2SO4=0,02(mol)
∑nBa(OH)2=0,03+0,02=0,05(mol)
V dd Ba(OH)2=0,05\0,2=0,25(lít)

Có lẽ bạn hiểu nhầm M (mol/l) với mol rồi :)
Sửa hết mol ---> M nha
\(a,n_{NaCl}=2,5.0,9=2,25\left(mol\right)\\ \rightarrow m_{NaCl}=2,25.58,5=131,625\left(g\right)\\ b,m_{MgCl_2}=\dfrac{4.50}{100}=2\left(g\right)\\ c,Đổi:250ml=0,25l\\ \rightarrow n_{MgSO_4}=0,1.0,25=0,025\left(mol\right)\\ \rightarrow m_{MgSO_4}=0,025.120=3\left(g\right)\\ d,m_{NaOH}=\dfrac{40.20}{100}=8\left(g\right)\)

a) \(n_{NaCl}=2,5.0,9=2,25\left(mol\right)\Rightarrow m_{NaCl}=2,25.58,5=131,625\left(g\right)\)
b) \(m_{MgCl_2}=\dfrac{50.4}{100}=2\left(g\right)\)
c) \(n_{MgSO_4}=0,25.0,1=0,025\left(mol\right)\Rightarrow m_{MgSO_4}=0,025.120=3\left(g\right)\)
d) \(m_{NaOH}=\dfrac{20.40}{100}=8\left(g\right)\)
Đáp án B
[OH-]= 10-3 (M), nOH-= 0,25.10-3=2,5.10-4 (mol)
Ba(OH)2 → Ba2+ + 2OH-
1,25.10-4 mol 2,5.10-4 mol
mBa(OH)2= 1,25.10-4.171=0,021375 gam