Trộn 100 ml dung dịch HCl 0,12 M với 100 ml dung dịch NaOH 0,1 M thu được dung dịch X. Nếu sự pha trộn không làm thay đổi thể tích các dung dịch, thì pH của dung dịch X là
A. 2
B. 10
C. 7
D. 1
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

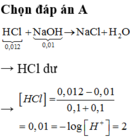

Đáp án : A
dd X : nH+ = 2nH2SO4 + nHCl = 0,02 mol
dd Y : nOH = nNaOH + 2nBa(OH)2 = 0,04 mol
=> Trong Y : nOH – nH+ = 0,02 mol = nOH- => COH = 0,1M => pH = 13

a) \(n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,1\cdot0,12+0,1\cdot0,04=0,016\)
\(C_M=\dfrac{0,016}{0,2}=0,08M\)
\(\Rightarrow pH=-log\left(0,08\right)=1,1\)
b) \(n_{OH^-}=n_{KOH}+2n_{Ba\left(OH\right)_2}=0,012+2\cdot0,004=0,02\)
\(C_M=\dfrac{0,02}{0,2}=0,1\)
\(\Rightarrow pH=-log\left(\dfrac{10^{-14}}{0,1}\right)=13\)

Câu 2 :
$n_{HCl} = 0,2.1 + 0,3.1,5 = 0,65(mol)$
$V_{dd} = 0,2 + 0,3 = 0,5(mol)$
$C_{M_{HCl}} = \dfrac{0,65}{0,5} =1,3M$
Câu 3 :
Gọi $m_{H_2O\ cần\ thêm} =a (gam)$
Sau khi thêm :
$m_{NaOH} = 100.35\% = 35(gam)$
$m_{dd} = 100 + a(gam)$
Suy ra: $\dfrac{35}{100 + a}.100\% = 20\%$
Suy ra: a = 75(gam)
Câu 4 :
Gọi $V_{dd\ HCl\ 2M} =a (lít) ; V_{dd\ HCl\ 3M} = b(lít)$
Ta có :
$a + b = 4$
$2a + 3b = 4.2,75$
Suy ra a = 1(lít) ; b = 3(lít)