Cho 400 ml dung dịch KOH 0,1M vào 400 ml dung dịch MgCl2 0,2M thu được m gam kết tủa. Giá trị của m là
A. 2,9.
B. 1,16
C. 2,32.
D. 4,64
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

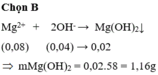

Chọn B
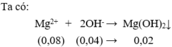
Theo PT Mg 2 + dư, số mol kết tủa tính theo số mol OH -
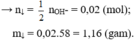

nNaHCO3 = 0,03; nK2CO3 = 0,06
nHCI = 0,02 và nNaHSO4 = 0,06 —> nH+ = 0,08
nHCO3- : nCO32- = 1 : 2 —> Đặt x, 2x là số
mol HCO3- và CO32- phản ứng.
—> nH+ = x + 2.2x = 0,08 => x = 0,016
—> nCO2 = x + 2x = 0,048
—>V=1,0752 lít
Dung dịch X chứa HCO3- dư (0,03 - x = 0,014), CO32- dư (0,06 - 2x = 0,028),
SO42-(0,06) và các ion khác.
nKOH = 0,06 —> Quá đủ để chuyển HCO3- thành CO32-.
nBaCl2 = 0,15 —> BaCO3 (0,014 + 0,028 =0,042) và BaSO4 (0,06)
→ m ↓ = 22 , 254
Đáp án A

Đáp án A
Vì hai thí nghiệm đều thu được cùng một lượng kết tủa và lượng KOH dùng ở thí nghiệm 2 lớn hơn lượng KOH dùng ở thí nghiệm 1 nên ở thí nghiệm 1 chưa có sự hòa tan kết tủa và ở thí nghiệm 2, sau khi lượng kết tủa đạt giá trị cực đại đã bị hòa tan một phần.
Áp dụng công thức cho hai trường hợp cùng thu được một lượng kết tủa ta có hệ phương trình


Chọn A
Fe2+ + 2OH- → Fe(OH)2↓
(0,04) (0,02) → 0,01
mFe(OH)2 = 0,01.90 = 0,9g

Đáp án C
n H + =0,02 + 0,06 = 0,08 mol
n H C O 3 - = 0,03 mol
n C O 3 2 - =0,06 mol
Đổ từ từ dung dịch axit vào hỗn hợp muối
CO32- + H+ → HCO3-
0,06 0,06 0,06
HCO3- + H+ →CO2 + H2O
0,02 0,02 mol
=> V = 0,448 l
HCO3- + OH- → CO32- + H2O
0,06 0,06 mol
n S O 4 2 - = 0 , 06 m o l
n B a 2 + = 0,15 mol
⇒ n B a S O 4 = n B a C O 3 = 0,06 mol
=>Vậy m = 0,06.233 + 0,06.197 = 25,8 gam