Khử hoàn toàn m gam hỗn hợp X gồm FeO và Fe2O3 bằng H2 (dư), thu được 9 gam H2O và 22,4 gam chất rắn. Phần trăm số mol của FeO trong hỗn hợp X là:
A. 66,67.
B. 20,56.
C. 26,67.
D. 40,67.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

cacs pthh :
Fe2O3 + 3H2 --t--> 2Fe + 3H2O
FeO+ H2 -t--> Fe+H2O
Fe3O4 +4H2 --t--> 3Fe + 4H2O

Đáp án D
Các phản ứng xảy ra:
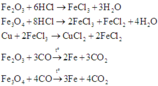
Nhận thấy: nO giảm = n O ( X ) = 1 2 n H C l = 0 , 5
⇒ a = m r ắ n s a u p h ả n ứ n g + m O g i ả m = 50 ( g a m )
Để tính được phần trăm khối lượng của Cu trong hỗn hợp X ta cần biết thêm khối lượng của Cu trong X.
Khi cho X vào dung dịch HCl dư thì chất rắn không tan còn lại sau phản ứng là Cu dư.
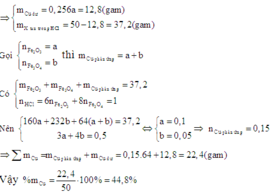

Đáp án : B
Hấp thụ CO2 vào Ca(OH)2 dư => chỉ tạo muối CaCO3
n CaCO3 = 6/100 = 0,06 mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,06 0,06
Ta có : n CO p/ứ = n CO2 = 0,06 mol
Áp dụng ĐLBTKL ta có :
m hX + mCO = mY + m CO2
=> mY = 8,73 + 0,06.28 - 0,06.44 = 7,76g

Giải thích:
Các phản ứng xảy ra hoàn toàn. Hỗn hợp rắn Y + NaOH thấy có H2 thoát ra => Al dư sau phản ứng nhiệt nhôm
Vậy hỗn hợp Y gồm Al2O3, Fe và Al dư
Phần 1: Bảo toàn e => nAl dư = 2/3nH2 = 2/3. 0,45 = 0,3 (mol)
Phần 2: Bảo toàn e: 3nFe + 3nAl dư = 3nNO => nFe = (3.0,7 – 3.0,3)/3 = 0,4 (mol)
=> m = mFe = 0,4. 56 = 22,4 (g)
Đáp án B

\(Đặt:n_{FeO}=a\left(mol\right),,n_{Fe_2O_3}=b\left(mol\right)\)
\(m_X=72a+160b=30.4\left(g\right)\left(1\right)\)
\(FeO+CÒ\underrightarrow{t^0}Fe+CO_2\)
\(Fe_2O_3+3CO\underrightarrow{t^0}2Fe+3CO_2\)
\(X:COdư,CO_2\)
\(m_X=m_{CO\left(dư\right)}+m_{CO_2}=\left(1-a-3b\right)\cdot28+\left(a+3b\right)\cdot44=36\left(g\right)\)
\(\Leftrightarrow16a+48b=8\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.2,b=0.1\)
\(m_{Fe}=\left(0.2+0.1\cdot2\right)\cdot56=22.4\left(mol\right)\)
\(m_{FeO}=0.2\cdot72=14.4\left(g\right)\)
\(m_{Fe_2O_3}=0.1\cdot160=16\left(g\right)\)

Đáp án A
Vì còn lại một phần chất rắn không tan nên Cu dư và trong dung dịch chứa FeCl2 và CuCl2
Có nO(A) = 0,5nHCl = 0,5
a = mkim loại + mO(A) = 42 + 16.0,5 = 50 (gam)
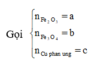
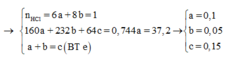
![]()
Đáp án A