Khi oxi hoá hoàn toàn 5,00 gam một hợp chất hữu cơ, người ta thu được 8,40 lít C O 2 (đktc) và 4,50 g H 2 O .
Xác định phần trăm khối lượng của từng nguyên tố trong hợp chất hữu cơ đó.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chất X chắc chắn có C, H, N ; có thể có O.
Khối lượng C: 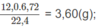
Khối lượng H: 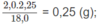
Khối lượng N: 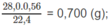
Khối lượng O: 6,15 - 3,60 - 0,25 - 0,700 = 1,60 (g).
% về khối lượng của C: 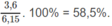
% về khối lượng của H: 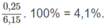
% về khối lượng của N: 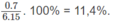
% về khối lượng của O: 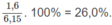

Gọi CTPT của hợp chất hữu cơ là CxHyOz (x, y, z nguyên dương; z ≥ 0)
Ta có:
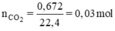
BT nguyên tố ⇒ nC = nCO2 = 0,03 mol ⇒ mC = 12. 0,03 = 0,36g
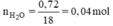
BT nguyên tố ⇒ nH = 2.nH2O = 2. 0,04 = 0,08 mol ⇒ mH = 0,08. 1 = 0,08 g
mO = 0,6 - 0,36 - 0,08 = 0,16(g)
⇒ Hợp chất A có chứa C, H, O
Phần trăm khối lượng các nguyên tố trong phân tử A là:


nC=nCO2=0,672:22,4=0,03
=> mC=0,03.12=0,36 g
=> %C=60%
nH2O=2.nH=2.0,72/18=0,08
=< mH=0,08
=> %H=13,3%
=> %O=100-13.3-60=26,7%

\(n_{CO_2}=\dfrac{1,32}{44}=0,03mol\Rightarrow n_C=0,03\Rightarrow m_C=0,36g\)
\(n_{H_2O}=\dfrac{0,54}{18}=0,03mol\Rightarrow n_H=0,06mol\Rightarrow m_H=0,06g\)
Nhận thấy \(m_C+m_H=0,42< m_A=0,9g\Rightarrow\)có chứa oxi.
\(\Rightarrow m_O=0,9-0,42=0,48g\)
Gọi CTHH là \(C_xH_yO_z\)
\(x:y:z=\dfrac{m_C}{12}:\dfrac{m_H}{1}:\dfrac{m_O}{16}=\dfrac{0,36}{12}:\dfrac{0,06}{1}:\dfrac{0,48}{16}=0,03:0,06:0,03\)
\(\Rightarrow x:y:z=1:2:1\Rightarrow CH_2O\)
Gọi CTPT là \(\left(CH_2O\right)_n\)
\(\Rightarrow M=180=30n\Rightarrow n=6\)
Vậy CTPT cần tìm là \(C_6H_{12}O_6\)
Nguyên tố C chiếm 90% và nguyên tố H chiếm 10% về khối lượng.