Hòa tan hoàn toàn 32 gam kim loại M trong dung dịch HNO3 dư thu được 8,96 lít hỗn hợp khí B gồm NO và NO2 ở đktc. Tỉ khối của B so với hiđro bằng 17. Kim loại M là
A. Al
B. Cu
C. Fe
D. Mg
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
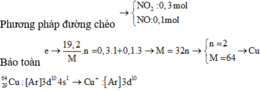
+) Ion M+ không có electron độc thân. → Đúng
+) Bột nhôm dùng để chế tạo hỗn hợp tecmit (hỗn hợp bột của Al và Fe2O3) → B Sai
+) M là nguyên tố hóa học thuộc nhóm VIIIB, chu kì 3 → SAI Cu thuộc chu kì 4 nhóm IB
+) Điện phân nóng chảy là phương pháp duy nhất dùng để điều chế kim loại M →SAI ngoài phương pháp điện phân nóng chảy còn phương pháp nhiệt luyện, thủy luyện, điện phân dung dịch.

Gọi số mol của Cu là a => nAl= 2a, nMg= 3a
mCu+mAl+mMg = 19 => a=0,1 =>nCu=0,1(mol);nAl=0,2(mol);nMg=0,3(mol)
dY/H2 =18,5 => M(Y)= 37 (dùng pp đường chéo) => nNO=nN2O
n(Y)= \(\dfrac{4,48}{22,4}\) =0,2 (mol)
Suy ra: nNO=nN2O= 0,1 (mol)
nNH4NO3 =\(\dfrac{\text{0,1.2+0,2.3+0,3.2−0,1.3−0,1.8 }}{8}\)=0,0375 (mol) bảo toàn e nhe
mm′ = mCu(NO3)2+ mAl(NO3)3 +mMg(NO3)2+mNH4NO3 = 108,8(g) ( khúc này bảo toàn nguyên tố Cu,Al,Mg => số mol của muối Cu2+,Al3+,Mg2+ )

Câu 1
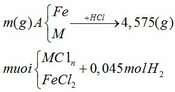
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
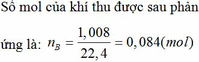
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
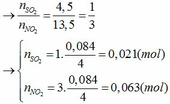
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
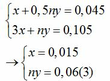
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

Ta đặt: nNO= x mol; nNO2= y mol
Ta có : nY= x+y= 6,72/22,4= 0,3 mol
mY= 30x+ 46y= nY.MY= 0,3.19.2
Giải hệ có x= 0,15 và y= 0,15
Đặt nFe= a mol ; nCu= b mol
QT cho e:
Fe → Fe3++ 3e
a 3a mol
Cu → Cu2++ 2e
b 2b mol
QT nhận e:
N+5+ 3e→ NO
0,45 0,15
N+5+ 1e→ NO2
0,15 0,15
Theo ĐL bảo toàn e có: ne cho= ne nhận nên 3a+2b= 0,45+ 0,15= 0,60
Mặt khác mkim loại= 56a+ 64b= 15,2
Giải hệ trên có a= 0,1, b= 0,15 →%mFe=36,84%
Đáp án C

Đáp án D
Đặt số mol NO là a mol; số mol NO2 là b mol
Suy ra a + b = 0,2 mol; 30a + 46b = 0,2.17.2 = 6,8 gam
Giải hệ trên ta có a = 0,15 và b = 0,05
Quá trình cho e:
Cu → Cu2++ 2e
Quá trình nhận e:
N+5 + 3e → N+2
N+5 + 1e → N+4
Áp dụng định luật bảo toàn e: 2.nCu = 3.nNO + 1.nNO2 → nCu = (3.nNO+ nNO2): 2 = 0,25 mol
Suy ra m = 0,25.64 = 16 gam
Đáp án B
Tính số mol các khí trong B:
Đặt số mol các khí trong B là NO : a mol ; NO2 : b mol
Số mol của M là: n M = 32 M m o l
Gọi n là hóa trị của M
Sơ đồ phản ứng: