Cho hỗn hợp gồm 0,2 mol Fe và 0,3 mol Mg vào dung dịch HNO 3 dư thu được 0,4 mol một sản phẩm khử chứa N duy nhất. Sản phẩm đó là
A. N 2 O
B. NO.
C. NO 2 .
D. NH 4 NO 3 .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Coi \(n_{Cu} = n_{FeO} = 1(mol)\\ n_{Fe} = x(mol)\)
Bảo toàn electron cho quá trình 1:
\(2n_{Fe} + 2n_{Cu} = 3n_{NO}\)
⇒ 2x + 2 = 3a(1)
Y gồm \(Cu(NO_3)_2,Fe(NO_3)_2\)
Bảo toàn electron cho quá trình 2 :
\(n_{Fe(NO_3)_2} = x + 1 = 3n_{NO}\)
⇒ x + 1 = 3b(2)
Lấy (1) : (2), ta có \(\dfrac{2x + 2}{x + 1} =\dfrac{3a}{3b} \Rightarrow \dfrac{a}{b} = 2\)

Đây là 1 bài tập tổng hợp khá khó, đòi hỏi phải tính toán khá nhiều song hướng giải lại rất cụ thể và rõ ràng đó là ta sẽ sử dụng định luật bảo toàn khối lượng để tính khối lượng muối:
![]()
Do đó nhiệm vụ bây giờ là phải tìm được
![]()
+) Tính được khối lượng hỗn hợp Q dễ dàng:
![]()
+) Vì HCl và HNO3 trong cùng 1 dung dịch cho nên tỉ lệ về số mol cũng chính là tỉ lệ về nồng độ.
Gọi n H C l = 3 a t h ì n H N O 3 = 4 a
⇒maxit = 3a.36,5 + 4a.63 = 361,5a (gam)
+) Sơ đồ bài toán:
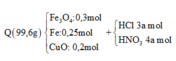
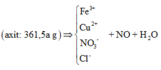
+) Ta lần lượt đi tìm các yếu tố còn thiếu:
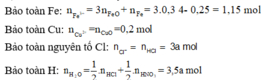
+) Áp dụng định luật bảo toàn điện tích ta có:
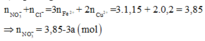
Tiếp tục sử dụng bảo toàn N:
![]()
![]()
Ta có:
m m u ố i = m F e 3 + + m C u 2 + + m C l - + m N O 3 -
![]()
= 315,9 - 79,5a (g)
Bây giờ ta cần phải tìm được a, nên nhớ là ta đã có các biểu diễn các yếu tố cần tìm theo a, do đó ta sử dụng định luật bảo toàn khối lượng: m Q + m a x i t = m m u ố i + m N O + m H 2 O
hay 99,6 + 361,5a = 315,9 - 79,5a + 30.(7a - 3,85) +18.3,5a ⟺ a = 0,6
Vậy khối lượng muối trong dung dịch sau phản ứng là:
mmuối = 315,9 - 79,5.0,6 = 268,2 (gam)
Đáp án A.

Đáp án B
![]()
=> Y chứa H + dư
![]()
![]()
Bảo toàn khối lượng:
![]()
![]()
![]()
Bảo toàn nguyên tố Hidro: n N H 4 + = 0 , 04 m o l
Bảo toàn nguyên tố Nito: n F e ( N O 3 ) 2 = 0 , 08 m o l
![]()
![]()
![]()
![]()
Bảo toàn e:
![]()
![]()
![]()
Bảo toàn nguyên tố Clo:
![]()
![]()
= 298,31 (g)
Giải hệ => x = 0,52 mol; y = 0,12 mol ![]()

Đáp án B
Thêm AgNO3 vào Y → NO chứng tỏ trong Y có chứa cặp H+ và Fe2+ → anion trong Y chỉ có Cl- mà thôi.
Lượng H+ dư được tính nhanh = 4nNO = 0,18 mol → lượng phản ứng là 1,64 mol.
Sơ đồ:
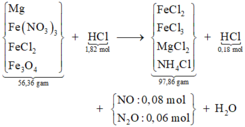
Bảo toàn khối lượng cả sơ đồ có
![]()
Theo đó, bảo toàn nguyên tố H có 0,04 mol NH4Cl và có 0,08 mol Fe(NO3)3 (theo bảo toàn N sau đó).
Tiếp tục theo bảo toàn electron mở rộng hoặc dùng bảo toàn O có ngay số mol Fe3O4 là 0,04 mol.
Gọi số mol Mg và FeCl2 trong X lần lượt là x, y mol → 24x + 127y = 27,72 gam.
Xét toàn bộ quá trình, bảo toàn electron ta có:


Đáp án B
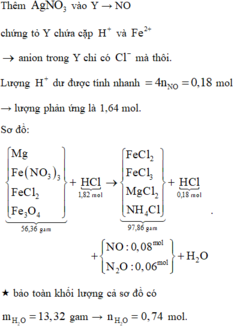
Theo đó, bảo toàn nguyên tố H có 0,04 mol NH4Cl và có 0,08 mol Fe(NO3)3 (theo bảo toàn N sau đó).
Tiếp tục theo bảo toàn electron mở rộng hoặc dùng bảo toàn O có ngay số mol Fe3O4 là 0,04 mol.
« Gọi số mol Mg và FeCl2 trong X lần lượt là x, y mol


Đáp án B
Thêm AgNO3 vào Y ® NO chứng tỏ trong Y có chứa cặp H+ và Fe2+ ® anion trong Y chỉ có Cl- mà thôi.
Lượng H+ dư được tính nhanh = 4nNO = 0,18 mol ® lượng phản ứng là 1,64 mol. Sơ đồ:
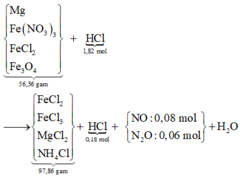
« Bảo toàn khối lượng cả sơ đồ có m H 2 O = 13 , 32 g a m → n H 2 O = 0 , 74 m o l
Theo đó, bảo toàn nguyên tố H có 0,04 mol NH4Cl và có 0,08 mol Fe(NO3)3 (theo bảo toàn N sau đó).
Tiếp tục theo bảo toàn electron mở rộng hoặc dùng bảo toàn O có ngay số mol Fe3O4 là 0,04 mol.
« Gọi số mol Mg và FeCl2 trong X lần lượt là x, ymol ® 24x + 127y = 27,72 gam.
Xét toàn bộ quá trình, bảo toàn electron ta có:
2 x + y + 0 , 04 = 8 × 0 , 04 + ( 0 , 08 + 0 , 045 ) × 3 + 0 , 06 × 8 + n A g → n A g = ( 24 x + Y - 1 , 1350 ) m o l
Lại có: . Tổng khối lượng kết tủa là 298,31 gam.
® có phương trình: 143,5.(2y+1,82)+108.(2x+y-1,135=298,31
Giải hệ các phương trình trên được x = 0,52 mol; y = 0,12 mol.
vậy yêu cầu: % m F e C l 2 t r o n g X = 0 , 12 × 127 56 , 36 × 100 % ≈ 27 , 04 % .
Chọn B