Cho 6,00 g P2O5 vào 25,0 ml dung dịch H3PO4 6,00% (D = 1,03 g/ml). Tính nồng độ phần trăm H3PO4 trong dung dịch tạo thành?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_3PO_4}=0,6.2=1,2\left(mol\right)\Rightarrow m_{H_3PO_4}=1,2.98=117,6\left(g\right)\)
mdd sau khi pha = 600.1,2+200.1,1 = 940 (g)
\(C\%_{ddH_3PO_4}=\dfrac{117,6.100\%}{940}=12,51\%\)
Cái 200ml dd H3PO4 có D=1,1g/ml thì cái đó có cho CM không? hay số mol gì đó

\(n_{H_2SO_4}=0.1\cdot2=0.2\left(mol\right)\)
\(m_{dd_{H_2SO_4}}=100\cdot1.2=120\left(g\right)\)
\(n_{BaCl_2}=0.1\cdot1=0.1\left(mol\right)\)
\(m_{dd_{BaCl_2}}=100\cdot1.32=132\left(g\right)\)
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
\(0.1................0.1.........0.1...............0.2\)
\(\Rightarrow H_2SO_4dư\)
\(m_{BaSO_4}=0.1\cdot233=23.3\left(g\right)\)
\(V_{dd}=0.1+0.1=0.2\left(l\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.2-0.1}{0.2}=0.5\left(M\right)\)
\(C_{M_{HCl}}=\dfrac{0.2}{0.2}=1\left(M\right)\)
\(m_{\text{dung dịch sau phản ứng}}=120+132-23.3=228.7\left(g\right)\)
\(C\%_{H_2SO_4\left(dư\right)}=\dfrac{0.1\cdot98}{228.7}\cdot100\%=4.28\%\)
\(C\%_{HCl}=\dfrac{0.2\cdot36.5}{228.7}\cdot100\%=3.2\%\)

Photpho cháy trong không khí lấy dư theo phản ứng :
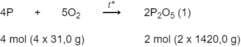
P 2 O 5 tác dụng với tạo thành H 3 P O 4 theo phản ứng :
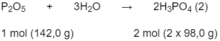
Theo phản ứng (1): 4 x 31,0 g P tạo ra 2 x 142,0 g P 2 O 5
a g P tạo ra 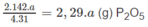
Theo các phản ứng (1) và (2) :
4 x 31,0 (g) P tạo ra 4 x 98,0 (g) H 3 P O 4
a (g) P tạo ra 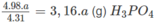
Khối lượng H 3 P O 4 có trong 500,0 ml dung dịch 85,00% :
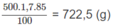
Khối lượng H 3 P O 4 sau khi đã hoà tan P 2 O 5 : 722,5 g + 3,16 x a g.
Khối lượng của dung dịch H 3 P O 4 sau khi đã hoà tan P 2 O 5 :
500,0 x 1,7 g + 2,29 x a g = 850,0 g + 2,29 x a g
Ta có phương trình về nồng độ phần trăm của dung dịch H 3 P O 4 :
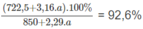
Giải phương trình được a = 62,16 g photpho.

Câu 1:
Ta có: \(n_{H_3PO_4}=0,15.1=0,15\left(mol\right)\)
\(n_{NaOH}=0,225.1=0,225\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{H_3PO_4}}=\dfrac{0,225}{0,15}=1,5\)
⇒ Pư tạo muối NaH2PO4 và Na2HPO4.
a, Giả sử: \(\left\{{}\begin{matrix}n_{NaH_2PO_4}=x\left(mol\right)\\n_{Na_2HPO_4}=y\left(mol\right)\end{matrix}\right.\)
BTNT Na, có: x + 2y = 0,225 (1)
BTNT P, có: x + y = 0,15 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,075\left(mol\right)\\y=0,075\left(mol\right)\end{matrix}\right.\)
⇒ mNaH2PO4 = 0,075.120 = 9 (g)
mNa2HPO4 = 0,075.142 = 10,65 (g)
b, \(C_{M_{NaH_2PO_4}}=C_{M_{Na_2HPO_4}}=\dfrac{0,075}{0,375}=0,2M\)
Câu 2:
Ta có: \(n_{H_3PO_4}=0,15\left(mol\right)\)
\(n_{KOH}=0,35\left(mol\right)\)
\(\Rightarrow\dfrac{n_{KOH}}{n_{H_3PO_4}}=2,333\)
Vậy: Pư tạo muối Na2HPO4 và Na3PO4.
a, Giả sử: \(\left\{{}\begin{matrix}n_{Na_2HPO_4}=x\left(mol\right)\\n_{Na_3PO_4}=y\left(mol\right)\end{matrix}\right.\)
BTNT Na, có: 2x + 3y = 0,35 (1)
BTNT P, có: x + y = 0,15 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Na_2HPO_4}=0,1.142=14,2\left(g\right)\)
\(m_{Na_3PO_4}=0,05.164=8,2\left(g\right)\)
b, Ta có: \(\left\{{}\begin{matrix}C_{M_{Na_2HPO_4}}=\dfrac{0,1}{0,5}=0,2M\\C_{M_{Na_3PO_4}}=\dfrac{0,05}{0,5}=0,1M\end{matrix}\right.\)
Bạn tham khảo nhé!

Đáp án C
nP2O5=1 mol
nH3PO4=23,72%.500/98=1,21 mol
P2O5 + 3H2O → 2H3PO4
1 3 2
nH3PO4=2+1,21=3,21 mol => C% H3PO4 (dd A) = 3,21.98/(142+500)=49%

Đáp án C
Ta có: nP2O5= 0,1 mol; mH3PO4 ban đầu= 250.9,8/100=24,5 gam
P2O5+ 3H2O→ 2H3PO4
0,1 0,2 mol
Tổng khối lượng H3PO4 là: 0,2.98+ 24,5=44,1 gam
Khối lượng dung dịch là: 14,2+ 250=264,2 gam
![]()


mdd H3PO4 = V. D = 25. 1,03 = 25,75g
mH3PO4(sau phản ứng) = 1,545 + 8,282 = 9,827(g)
Khối lượng dung dịch sau phản ứng = 25,75 + 6 = 31,75(g)