Cho 12,8 gam kim loại A hóa trị II phản ứng hoàn toàn với khí Cl2 thu muối B. Hòa tan B vào nước thu được 400ml dung dịch C. Nhúng thanh sắt nặng 11,2 gam vào dung dịch C, sau một thời gian thấy kim loại A bám vào thanh sắt và khối lượng thanh sắt là 12,0 gam, nồng độ FeCl2 trong dung dịch là 0,25M. Xác định kim loại A và nồng độ mol của kim loại B trong dung dịch C.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
A → An+
nFe + 2An+ → nFe2+ + 2A
2,2A/n - 5,6 = 12 -11,2 = 0,8→ A = 32n→A = 64 (Cu)
CM = 12,8/(64.0,4) = 0,5M

a) MH2+2AgNO3 ->M(NO3)2+2AgH
Fe+MH2 -> FeH2+M
gọi x là số mol của MH2 ở mỗi phần
x(M-56)=0,16=>x=0,16/(M-56)
=>nAgH=0,32/(M-56)
Ta có
mAgH=5,74=>0,32x(108+H)/(M-56)=5,74
=>(108+H)/(M-56)=17,9375
=>17,9375M-H=1112,5
thay H lần lượt là Cl , Br và I ta có
H là Cl thì M là Cu
=>CTHH của X là CuCl2
b)
ta có x(64-56)=0,16=>x=0,02 mol
=>mCuCl2=0,02x2x135=5,4 g

F e + C u N O 3 2 → F e N O 3 2 + C u
x……….x………..x………x……mol
Theo phương trình ta có nhận xét là thanh sắt tăng lên 0,8 gam thì dung dịch sẽ giảm khối lượng đi 0,8 gam (theo định luật bảo toàn khối lượng)
⇒ m d d = m d d bđ - 0,8 =3,28 - 0,8 = 2,48 g
⇒ Chọn B.

Đáp án D
![]()
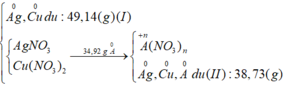
Tổng khối lượng các kim loại (I) + kim loại (II) = khối lượng của Cu, Ag và A dư
=> mA dư = m(I) + m(II) – mCu - mAg
=> mA dư = 49,14 + 38,73 – 30,3 – 0,3.108 = 25,17 (g)
=> mA phản ứng = 34,92 – 25,17 = 9,75(g)
Sau tất cả quá trình Cu0 vẫn về Cu0; Ag+ về Ag0 ;A0 về A+n
=> ne(Ag+ nhận) = ne( A nhường) = 0,3 (mol)
Ag+ +1e→ Ag
0,3 → 0,3 (mol)
A - ne → A+n
0,3/n ← 0,3
![]()
Vậy n =2 thì A = 65 sẽ thỏa mãn
Vậy A là Zn

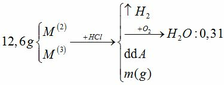
Đồng nhất dữ kiện để thuận lợi cho tính toán, bằng cách nhân đôi khối lượng H2O.
a.
BTNT H: nH2 = nH2O = 0,31 mol
=> nHCl = 0,62mol
BTKL: m kim loại + mHCl = mA + mB => 12,6 + 36,5 . 0,62 = m + 2 . 0,31 => m = 34,61g
b.
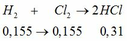
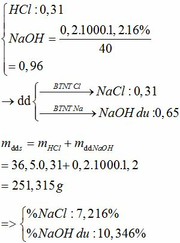





số mol FeCl2 là n = 0,25 . 0,4 = 0,1 (mol)
gọi x là số mol Fe phản ứng
khối lượng kim loại tăng là Δm = mA - mFe = Ax – 56x = 0,8
x = 0,1 → A.0,1 – 56.0,1 = 0,8 → A = 64. A là Cu
số mol Cu là nCu =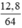 = 0,2 (mol)
= 0,2 (mol)
số mol CuCl2 → n(CuCl2) = nCu = 0,2 (mol)
nồng độ mol/l CuCl2 là C(M(CuCl2)) =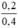 = 0,5M
= 0,5M