Sục khí 6,72 lít CO2 (đktc) vào dung dịch có chứa 0,25 mol Ca(OH)2. Khối lượng kết tủa thu được là :
A. 10g.
B. 15g.
C. 20g.
D. 25g.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
nCO2 = 6,72: 22,4 = 0,3 mol
nCa(OH)2 = 0,25.1 = 0,25 mol => nOH = 2nCa(OH)2 = 0,5 mol
Ta thấy: nCO2 < nOH < 2nCO2
=> phản ứng tạo hỗn hợp muối HCO3 và CO3
=> nCO3 = nOH – nCO2 = 0,5 – 0,3 = 0,2 mol < nCa2+
=> nCaCO3 = nCO3 = 0,2 mol
=> mkết tủa = 0,2. 100 = 20g

\(n_{CO_2}=0,12\left(mol\right);n_{Ca\left(OH\right)_2}=0,1\left(mol\right)\Rightarrow n_{OH^-}=0,2\left(mol\right)\\ Tacó:\dfrac{n_{OH^-}}{n_{CO_2}}=1,67\\ \Rightarrow Tạo2muốiCaCO_3vàCa\left(HCO_3\right)_2\\ Đặt:\left\{{}\begin{matrix}n_{CaCO_3}=x\left(mol\right)\\n_{Ca\left(HCO_3\right)_2}=y\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x+2y=0,12\left(BTNT\left(C\right)\right)\\x+y=0,1\left(BTNT\left(Ca\right)\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,08\\y=0,02\end{matrix}\right.\\ \Rightarrow m_{CaCO_3}=0,08.100=8\left(g\right)\)

Đáp án D
Lượng CO 2 tham gia phản ứng và lượng Ba ( OH ) 2 ở hai thí nghiệm đều bằng nhau, nhưng ở TN1 thu được lượng kết tủa ít hơn ở TN2. Suy ra ở TN1 kết tủa đã bị hòa tan một phần. Dựa vào tính chất của đồ thị ở TN1 suy ra :
n CO 2 = 2 n Ba ( OH ) 2 - n BaCO 3 = ( 2 a - 0 , 1 ) mol
Đồ thị biểu diễn sự biến thiên lượng kết tủa theo lượng CO 2 ở TN1 và TN2 :
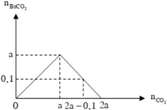
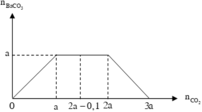
Dựa vào 2 đồ thị, ta thấy a < 2a - 0,1 < 2a nên ở TN2 kết tủa đạt cực đại. Suy ra :
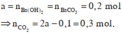
Vậy V = 6,72 lít và a = 0,2 mol
Đáp án C.
Số mol CO2 là: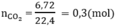
Theo pt (1): nCO2 = nCa(OH)2 = 0,25 mol
nCO2 (dư ) = 0,3 – 0,25 = 0,05 (mol)
Xảy ra phản ứng:
Theo pt(2): nCaCO3 pư = nCO2 = 0,05 mol
Như vậy CaCO3 không bị hòa tan là: 0,25 – 0,05 = 0,2(mol)
Khối lượng kết tủa thu được là m = 0,2. 100 = 20(g)