Dưới đây là thành phần phần trăm của các đồng vị thuộc hai nguyên tố
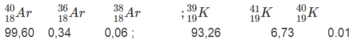
Hãy tính nguyên tử khối trung bình của Ar và K (một cách gần đúng coi nguyên tử khối của các đồng vị trùng với số khối của chúng).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi x là thành phần phần trăm của đồng vị Li 7 , thành phần phần trăm của đồng vị Li 6 sẽ là : 100 – x. Từ đó ta có phương trình :
![]()
Giải ra ta được x = 94 (94% Li 7 ) và 100 - x = 6 (6% Li 6 )

Gọi x là thành phần phần trăm của H 1 thành phần phần trăm của H 1 2 sẽ là 100 –x
![]()
Giải ra ta được: x = 99,2.
Kết quả:thành phần : H 1 1 là 99,2%
H 1 2 là 0.8%

Trong trường hợp này ta thấy mặc dù Ar có số đơn vị điện tích hạt nhân hay số proton (Z = 18) nhỏ hơn K (Z = 19) nhưng lại có nguyên tử khối trung bình lớn hơn Kế
Sở dĩ như vậy là vì đồng vị nặng của Ar ( Ar 40 ) có thành phần tuyệt đối lớn (99,60%), trong khi đó, đồng vị nhẹ của K ( K 39 ) lại có thành phần tuyệt đối lớn (93,26%).
Nguyên tử khối trung bình của Ar :
Nguyên tử khối trung bình của K :