Hỗn hợp khí X gồm ozon và oxi có tỉ khối đối với hiđro bằng 18. Phần trăm theo thể tích mỗi khí trong hỗn hợp X lần lượt là:
A. 25% và 75%
B. 30% và 70%
C. 35% và 65%
D. 40% và 60%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

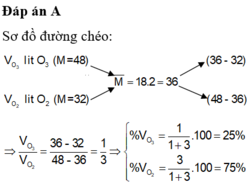


Đáp án D
Coi số mol hỗn hợp X = 1 mol.
nO2 = x (mol) ; nO3 = y (mol)
x + y = 1
32x + 48y = 1.18.2
⇒ x = 0,75, y = 0,25 (mol)
⇒ %VO2 = 75% ; %VO3 = 25%

Khối lượng mol trung bình của hỗn hợp khí:
M = 18 x 2 = 36(g/mol)
Đặt x và y là số mol O 3 và O 2 có trong 1 mol hỗn hợp khí, ta có phương trình đại số :
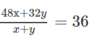
Giải phương trình, ta có y = 3x. Biết rằng tỉ lệ phần trăm về số mol khí cũng là tỉ lệ về thể tích : Thể tích khí oxi gấp 3 lần thể tích khí ozon. Thành phần của hỗn hợp khí là 25% ozon và 75% oxi.

a) Gọi nO2 =a (mol); nO3 = b(mol)
Có: \(\dfrac{32a+48b}{a+b}=20.2=40\)
=> 32a + 48b = 40a + 40b
=> 8a = 8b => a = b
=> \(\left\{{}\begin{matrix}\%V_{O_2}=\dfrac{a}{a+b}.100\%=\dfrac{a}{a+a}.100\%=50\%\\\%V_{O_3}=100\%-50\%=50\%\end{matrix}\right.\)
b) Gọi nN2 =a (mol); nNO = b(mol)
Có: \(\dfrac{28a+30b}{a+b}=14,75.2=29,5\)
=> 28a + 30b = 29,5a + 29,5b
=> 1,5a = 0,5b
=> 3a = b
=> \(\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{a}{a+b}.100\%=\dfrac{a}{a+3a}.100\%=25\%\\\%V_{NO}=100\%-25\%=75\%\end{matrix}\right.\)