Cho 10ml dung dịch X gồm HCl 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần để trung hoà dung dịch X đã cho là:
A. 10ml
B. 15ml
C. 20ml
D. 25ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Thí nghiệm 1 có nOH-= nH+
Nên 30.2= 20.C1+ 20.C2+ 30.1
Thí nghiệm 2 có nOH-= nH+
Nên 10.C1+ 20.C2 = 1.20
Suy ra C1 = 1,0 và C2 = 0,5

Chọn C
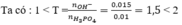
Vậy sau phản ứng thu được hai muối NaH 2 PO 4 và Na 2 HPO 4 .

Giả sử: \(C_{M\left(KOH\right)}=x\left(M\right)\)
Ta có: \(n_{H^+}=2n_{H_2SO_4}=2.0,015.0,5=0,015\left(mol\right)\)
\(\Sigma n_{OH^-}=0,01x+0,003\left(mol\right)\)
PT ion: \(OH^-+H^+\rightarrow H_2O\)
Do sau pư thu được dung dịch trung hòa nên:
\(n_{OH^-}=n_{H^+}\)
\(\Rightarrow0,01x+0,003=0,015\)
\(\Rightarrow x=1,2\)
Bạn tham khảo nhé!
Lộc Trần
Trên bài làm của mình đâu có n = V/CM như bạn nói đâu nhỉ? :vv

nHCl= 0,02; nH2SO4 = 0,01
=> nH+=0,04
H+ + OH- ---> H2O
0,04 0,04
=> nNaOH= 0,04
=> V = 0,08(l)

\(PTHH:NaOH+HCl\rightarrow NaCl+H2O\)
\(2NaOH+H2SO4\rightarrow Na2SO4+H2O\)
Ta có : \(n_{HCL}=0,02\left(mol\right)\)
\(\Rightarrow n_{NaOH}=0,04\left(mol\right)\)
\(\Rightarrow V_{dd_{NaOH}}=\frac{0,04}{0,5}=0,08l=80ml\)
NaOH +HCl---.NaCl +H2O(1)
2NaOH +H2SO4----,Na2SO4+H2O(2)
n\(_{HCl}=0,01.2=0,02\left(mol\right)\)
n\(_{H2SO4}=0,01.1=0,01\left(mol\right)\)
Theo pthh1
n\(_{NaOH}=n_{HCl}=0,02\left(mol\right)\)
Theo pthh2
n\(_{NaOH}=2n_{H2SO4}=0,02\left(mol\right)\)
\(\Sigma n_{NaOH}=0,02+0,02=0,04\left(mol\right)\)
V\(_{NaOH}=\frac{0,04}{0,5}=0,08\left(l\right)=80ml\)

Giải thích: Đáp án D
Glutamic: 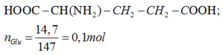
Ta có ∶ Glu + (HCl,H2SO4) ⟶ Muối
Bảo toàn khối lượng ta có :
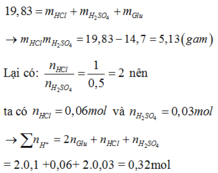
Suy ra số mol OH− cần để phản ứng với số chất tan trong dung dịch X cũng là số mol OH−phản ứng với tổng số mol H+
![]()
Đáp án C
nH+ = 0,01.1 + 2.0,01.0,5 = 0,02
nNaOH = nOH- = nH+ = 0,02 ⇒ VNaOH= 0,02l = 20ml.