Tính V lít dung dịch Ba(OH)2 0,025M cần cho vào 100ml dung dịch HNO3 và HCl có pH = 1 để thu được dung dịch cuối cùng có pH = 2.
A. 0,15
B. 0,51
C. 0,2
D. Đ/a khác
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nH+ ban đầu = 0,1.2.0,1 + 0,2.0,1 + 0,3.0,1 = 0,07
dung dịch C có pH=1 ⇒ nH+/C = 0,1.(0,3 + V)
⇒ nH+ ban đầu = nH+/C + nOH- ⇒ 0,07 = 0,1.(0,3 + V) + 0,2V +0,1.2V
⇒ V =0,08l

Đáp án : B
Trong X :
n H + = 2 n H 2 S O 4 + n H C l + n H N O 3 = 0,21 mol
Trong Y : nOH = nNaOH + 2 n B a O H 2 = 0,4V mol
Vì dung dịch sau trộn có pH = 1 < 7 => axit dư
=> n H + Z = (V + 0,3).10-pH= 0,21 – 0,4V
=> V = 0,36 lit

Đáp án : D
nOH = nKOH + 2nBa(OH)2 = 0,005 mol
nH+ = nHCl = 0,16V.10-3 mol
=> [H+] = 10-pH
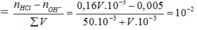
=> V = 36,67 ml
Đáp án A
