Sục từ từ 0,06 mol CO2 vào V (lít) dung dịch có chứa Ba(OH)2 0,5M thu được 2b mol kết tủa. Mặt khác khi sục 0,08 mol CO2 vào V lít dung dịch Ba(OH)2 0,5 M thì thu được b mol kết tủa. V có thể là:
A. 0,01998
B. 0,01997
C. 0,2015
D. 0,1010
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Lượng CO 2 tham gia phản ứng và lượng Ba ( OH ) 2 ở hai thí nghiệm đều bằng nhau, nhưng ở TN1 thu được lượng kết tủa ít hơn ở TN2. Suy ra ở TN1 kết tủa đã bị hòa tan một phần. Dựa vào tính chất của đồ thị ở TN1 suy ra :
n CO 2 = 2 n Ba ( OH ) 2 - n BaCO 3 = ( 2 a - 0 , 1 ) mol
Đồ thị biểu diễn sự biến thiên lượng kết tủa theo lượng CO 2 ở TN1 và TN2 :
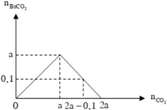
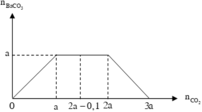
Dựa vào 2 đồ thị, ta thấy a < 2a - 0,1 < 2a nên ở TN2 kết tủa đạt cực đại. Suy ra :
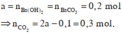
Vậy V = 6,72 lít và a = 0,2 mol

Chọn D
nCO2 dùng ở 2 thí nghiệm là như nhau nhưng TN2 cho nhiều BaCO3 hơn TN1
Þ Trong dung dịch sau phản ứng của TN1 còn Ba2+ cùng với CO32− hoặc HCO3-
Þ Dung dịch sau phản ứng của TN1 chỉ có Ba(HCO3)2.
Vậy ở TN1 bản chất là giống thí nghiệm 1 tạo ra 0,1 mol BaCO3 và dung dịch có a – 0,1 mol Ba(HCO3)2
Lượng NaOH thêm vào là a > nBa(HCO3)2 Þ Toàn bộ Ba2+ đã kết tủa
Þ a – 0,1 = 0,1 Þ a = 0,2; BTNT.C Þ nCO2 = 0,1 + 0,1.2 = 0,3 Þ V = 6,72.

n OH = 0,4 + 0,2.2 = 0,8(mol)
n CO3 2- = x(mol) ; n HCO3 - = y(mol)
Ta có :
x + y = 0,5
2x + y = 0,8
=> x = 0,3 ;y = 0,2
Ba2+ + CO32- → BaCO3
0,2.......0,2............................(mol)
Vậy dung dịch gồm :
K+ : 0,4(mol)
CO3 2- : 0,3 - 0,2 = 0,1(mol)
HCO3 - : 0,2(mol)
n HCl = a(mol) => n H2SO4 = 0,5a(mol)
=> n H+ = 2a(mol)
Gọi n CO3 2- pứ = 0,1b => n HCO3- pư = 0,2b(mol)
Ta có :
n H+ = 0,1b.2 + 0,2b
=> 0,4b = 2a
Sau phản ứng :
Bảo toàn nguyên tố với C :
n BaCO3 = 0,2 + 0,1 - 0,1b - 0,2b = 0,3 - 0,3b
Ta có :
0,5a.233 + (0,3 - 0,3b).197 = 41,2
=> a = 0,1 ; b = 0,05
=> n CO2 = 3b = 0,15
=> V = 3,36 lít
Mk muốn đc joir tại sao nH+=0.1b×2 + 0.2b
Bạn bảo toàn gì hay sao, giải thích giúp mk với

\(n_{CaCO_3} = \dfrac{30}{100} = 0,3(mol < n_{Ca(OH_2}\) nên xét 2 TH
- TH1 : Ca(OH) dư
Ca(OH)2 + CO2 → CaCO3 + H2O
....................0,3.........0,3.................(mol)
=> V = 0,3.22,4 = 6,72 lít
- TH2 : CaCO3 bị hòa tan 1 phần
Ca(OH)2 + CO2 → CaCO3 + H2O
0,5..............0,5...........0,5..................(mol)
CaCO3 + CO2 + H2O → Ca(HCO3)2
(0,5-0,3)......(0,5-0,3).............................................(mol)
=> V = (0,5 + 0,5 - 0,3).22,4 = 15,68 lít
Đáp án C
Trường hợp 1: Thí nghiệm ban đầu chưa có phản ứng hòa tan một phần kết tủa
Trường hợp 2: Thí nghiệm ban đầu đã có phản ứng hòa tan hoàn toàn kết tủa
Áp dụng công thức giải nhanh
Thí nghiệm 1 có 2b = 0,5V - 0,06
Thí nghiệm 2 có b = 0,5V - 0,08
Tại sao lại ra đc 0,1 vậy ạ