Cho m gam bột Cu vào 200ml dung dịch AgNO3 0,2M, sau phản ứng thu được 3,88 gam chất rắn X và dung dịch Y. Cho 2,925 gam bột Zn vào dung dịch Y sau phản ứng thu được 5,265 gam chất rắn Z và dung dịch chỉ chứa 1 muối duy nhất. Giá trị của m là
A. 3,17
B. 2,56
C. 1,92
D. 3,2.

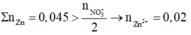
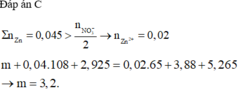
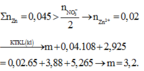
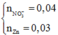

n A g N O 3 = 0 , 2 . 0 , 2 = 0 , 04
Thông thường, khi đọc xong đề bài các bạn sẽ viết các phản ứng:
Cu + 2AgNO3⟶Cu(NO3 )2 + 2Ag
Zn + Cu(NO3)2 ⟶ Zn(NO3)2 + Cu
Zn + 2AgNO3 ⟶ Zn(NO3)2 +2Ag.
Tuy nhiên phản ứng giữa Cu và AgNO3 ta không thể biết được chất nào dư, chất nào hết, do đó nếu làm theo cách bình thường ta sẽ thử xét 2 trường hợp, nhưng khi cho Zn vào dung dịch Y thì thì ta cũng không biết được chất nào dư, chất nào hết.
Do đó nếu nhìn theo cách bình thường thì bài toán trở nên rất phức tạp.
Tuy nhiên đọc lại đề bài 1 lần nữa, ta thấy có một giả thiết quan trọng là “dung dịch chỉ chứa 1 muối duy nhất”, đây chính là nút thắt của bài toán.
Dễ thấy dung dịch sau phản ứng chỉ chứa muối Zn(NO3)2
⇒ Tất cả ion sẽ đi hết vào muối Zn(NO3)2.
Khi ta không biết rõ chất nào dư hay hết, phản ứng đã xảy ra hoàn toàn hay chưa thì chúng ta nên nghĩ đến định luật bảo toàn khối lượng:
Cộng vế theo vế 2 phương trình trên ta được:
Hay m = 3,88 + 0,02.189 + 5,265 - 0,04.170 - 2,925 = 3,2 gam.
Đáp án D.