Để phân biệt các dung dịch riêng biệt đựng trong các lọ mất nhãn: NH4NO3, (NH4)2CO3, ZnCl2, BaCl2, FeCl2 chỉ cần dùng 1 thuốc thử là:
A. dung dịch NaOH
B. dung dịch HCl
C. dung dịch CaCl2
D. quỳ tím
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D
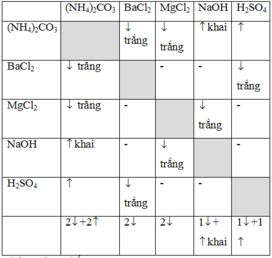
Theo bảng trên ta thấy
Mẫu thử nào có 2 kết tủa + 2 khí thoát ra là (NH4)2CO3
Mẫu thử nào có 1 kết tủa + 1 khí mùi khai thoát ra là NaOH
Mẫu thử nào có 1 kết tủa + 1 khí không màu thoát ra là H2SO4
Hai mẫu thử cùng xuất hiện 2 kết tủa là MgCl2 và BaCl2
Nhỏ dung dịch NaOH vừa nhận vào hai ống nghiệm này
Ống nghiệm nào xuất hiện kết tủa: MgCl2
Ống nghiệm còn lại chứa BaCl2 không có hiện tượng gì

- Lấy mỗi chất một ít làm mẫu thử và đánh STT.
- Nhúng quỳ tím vao các mẫu thử.
+ Mẫu làm quỳ hóa đỏ: HCl, H2SO4
+ Mẫu làm quỳ hóa xanh: Ba(OH)2, NaOH
+ Mẫu không làm quỳ đổi màu: NaCl, BaCl2
- Lấy một trong 2 axit cho tác dụng với muối:
TH1: Trong các mẫu muối không phản ứng => Axit đã dùng là HCl => Axit còn lại là H2SO4.
Cho axit H2SO4 tác dụng với muối.
+ Mẫu không phản ứng: NaCl
+ Mẫu phản ứng, tạo kết tủa trắng: BaCl2
\(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
Cho axit H2SO4 tác dụng với các bazo.
+ Mẫu phản ứng nhưng không có hiện tượng đặc trưng: NaOH
+ Mẫu phản ứng, tạo kết tủa trắng: Ba(OH)2
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2H_2O\)
TH2: Trong các mẫu muối có một mẫu phản ứng, tạo kết tủa trắng => Mẫu muối đó là BaCl2 => Mẫu muối còn lại là NaCl, mẫu axit đã dùng là H2SO4 => Mẫu axit còn lại là HCl. (Phương trình tương tự bên trên)
Tương tự cho axit H2SO4 tác dụng với bazo như trên để nhận biết 2 bazo còn lại.

Đáp án A
Để phân biệt các dung dịch: H C l , K O H , C a ( N O 3 ) 2 , B a C l 2 người ta dùng quì tím và A g N O 3 vì:
|
|
HCl |
KOH |
C a ( N O 3 ) 2 |
B a C l 2 |
| Quì tím |
Đỏ |
Xanh |
Tím |
Tím |
| A g N O 3 |
x |
x |
Không hiện tượng |
Kết tủa trắng |
Dấu x là đã nhận biết được rồi
Phương trình hóa học: B a C l 2 + 2 A g N O 3 → 2 A g C l ↓ + B a ( N O 3 ) 2

- Dùng quỳ tím
+) Hóa đỏ: HCl và AgNO3 (Nhóm 1)
+) Hóa xanh: K3PO4
+) Không đổi màu: NaNO3 và (NH4)2CO3
- Đổ dd BaCl2 vào từng nhóm
+) Xuất hiện kết tủa: AgNO3 (Nhóm 1) và (NH4)2CO3 (Nhóm 2)
PT: \(Ag^++Cl^-\rightarrow AgCl\downarrow\)
\(Ba^{2+}+CO_3^{2-}\rightarrow BaCO_3\downarrow\)
+) Không hiện tượng: HCl (Nhóm 1) và NaNO3 (Nhóm 2)
Đáp án A
Hướng dẫn giải:
Cho dung dịch NaOH vào các dung dịch trên:
-Dung dịch nào làm xuất hiện chất khí có mùi khai thì đó là NH4NO3 và (NH4)2CO3
NaOH + NH4NO3 → NaNO3+ NH3+ H2O
2NaOH + (NH4)2CO3 → Na2CO3+ 2NH3+ 2H2O
-Dung dịch nào làm xuất hiện kết tủa trắng sau đó tan trong kiềm dư thì đó là ZnCl2
ZnCl2+ 2NaOH → Zn(OH)2 ↓ + 2NaCl
Zn(OH)2 + 2NaOH → Na2ZnO2+ 2H2O
-Dung dịch nào xuất hiện kết tủa trắng xanh sau đó hóa nâu ngoài không khí thì đó là FeCl2
FeCl2+ 2NaOH → Fe(OH)2 ↓ + 2NaCl
-Dung dịch nào không có hiện tượng gì thì đó là BaCl2
Lấy dung dịch BaCl2 vừa nhận được ở trên vào NH4NO3 và (NH4)2CO3:
-Dung dịch nào làm xuất hiện kết tủa trắng thì đó là (NH4)2CO3
(NH4)2CO3+ BaCl2 → BaCO3 ↓ + 2NH4Cl
-Dung dịch nào không có hiện tượng gì thì đó là NH4NO3