Cho 2,6 gam bột kẽm vào 100 ml dung dịch CuCl 2 0,75M. Lắc kĩ cho đến khi phản ứng kết thúc. Xác định số mol của các chất trong dung dịch thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nZn= 2,6/65 = 0,04( mol)
nCuCl2= 0,1 . 0,75 = 0.075 ( mol)
Zn + CuCl2 → ZnCl2 + Cu
0,04 mol → 0,04 mol→0,04 mol
Trong dung dịch thu đc ta có:
nZnCl2 = 0,04 ( mol)
nCuCl2 = 0,075 - 0,04 = 0,035 ( mol)

\(n_{AgNO_3}=0,009.2=0,018\left(mol\right)\\ n_{NaX}=1,5.0,01=0,015\left(mol\right)\\ NaX+AgNO_3\rightarrow AgX\downarrow+NaNO_3\\ Vì:\dfrac{0,018}{1}>\dfrac{0,015}{1}\\ \Rightarrow AgNO_3dư\\ \Rightarrow n_{AgX}=n_{NaX}=0,015\left(mol\right)\\ \Rightarrow M_{AgX}=\dfrac{2,82}{0,015}=188\left(\dfrac{g}{mol}\right)=M_{Ag}+M_X=M_X+108\\ \Leftrightarrow M_X=80\left(\dfrac{g}{mol}\right)\\ \Rightarrow X:Brom\left(Br=80\right)\\ 2,dd.sau.phản.ứng:AgNO_3\left(dư\right),NaNO_3\\ n_{AgNO_3\left(p.ứ\right)}=n_{NaNO_3}=n_{NaBr}=0,015\left(mol\right)\\ \Rightarrow n_{AgNO_3\left(dư\right)}=0,018-0,015=0,003\left(mol\right)\)

nKOH : nNaOH = 1,25 : 0,75 = 5 : 3
=> Gộp 2 kiềm thành ROH (2V mol) với R = \(\dfrac{39,5+23,3}{8}\) = 33
nP2O5 = 0,05 =>; nH3PO4 = 0,1
+ Nếu sản phẩm là RH2PO4 (0,1 mol)
=> mRH2PO4 = 13
Nếu sản phẩm là R2HPO4 (0,1 mol)
=> mR2HPO4 = 16,2
+ Nếu sản phẩm là R3PO4 (0,1 mol)
=>mR3PO4 = 19,4
Theo đề thì m rắn = 24,4 > 19,4
=>Chất rắn gồm R3PO4 (0,1 mol) và ROH dư
->nROH dư = 0,1
Bảo toàn R
->nROH = 2V = 0,4
=>V = 0,2 lít = 200 ml.

Đáp án A
Dung dịch sau phản ứng chắc chắn có chứa các ion K + , Na + , Cl - . Mặt khác, n K + + n Na + > n Cl - , suy ra dung dịch sau phản ứng còn chứa ion âm, đó là Al OH 4 - . Theo bảo toàn điện tích, ta có :

![]()
![]()
= 0,05 mol
![]()

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
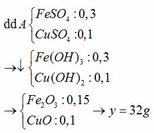

Đáp án C
+ n C u C l 2 = 0 , 02 m o l ; n F e C l 2 = 0 , 03 m o l ; n F e C l 3 = 0 , 03 m o l . + T í n h o x i h ó a : F e 3 + > C u 2 + > F e 2 + . ∙ TH 1 : T g ồ m F e 2 O 3 , M g O B T E : 2 n M g ⏟ x = n F e 3 + ⏟ 0 , 03 + 2 n C u 2 + ⏟ 0 , 02 + 2 n F e 2 + p ¨ o ⏟ y m T = 40 n M g O ⏟ x + 160 n F e 2 O 3 ⏟ 0 , 03 - 0 , 5 y = 5 , 4 ⇒ x = 0 , 055 ; y = 0 , 02 m M g = 1 , 32 ∙ TH 2 : T g ồ m C u O , F e 2 O 3 , M g O B T E : 2 n M g ⏟ x = n F e 3 + ⏟ 0 , 03 + 2 n C u 2 + p ¨ o ⏟ y m T = 40 n M g O ⏟ x + 160 n F e 2 O 3 ⏟ 0 , 03 + 80 n C u O ⏟ 0 , 02 - y = 5 , 4 ⇒ x = 0 , 055 y = 0 , 04 ( v ô l ý )
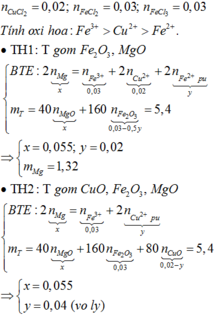

n Zn = 2,6/65 = 0,04 mol
n CuCl 2 = 0,75 x 0,1 = 0,075 mol
Zn + CuCl 2 → ZnCl 2 + Cu
Trong dung dịch thu được ta có:
n ZnCl 2 = 0,04 mol
n CuCl 2 = 0,075 - 0,04 = 0,035 mol