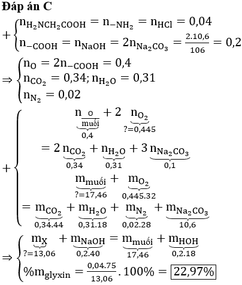
Đốt cháy hoàn toàn 0,3 mol hỗn hợp metan và etilen. Lấy toàn bộ lượng khí CO2 sinh ra cho vào dung dịch Ca(OH)2 dư thu được 40 gam kết tủa. Tính phần trăm về thể tích mỗi khí trong hỗn hợp ban đầu (các khí trên đo ở cùng điều kiện).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

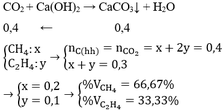

Gọi số mol của CH4 và C2H2 lần lượt là a và b
CH4 + 2O2 ➝ CO2 + 2H2O
a 2a a
C2H2 + 2,5O2 ➝ 2CO2 + H2O
b 2,5b 2b
CO2 + Ca(OH)2 ➝ CaCO3 + H2O
a + 2b a + 2b
Số mol của hỗn hợp khí: a + b = 4,48/22,4 = 0,2 mol
Số mol kết tủa: a + 2b = 30/100 = 0,3 mol
➝ a = 0,1 mol, b = 0,1 mol
a) %VC2H2 = %VCH4 = 50%
b) Tổng số mol khí O2 đã dùng: a + 2,5b = 0,35 mol
➝ VO2 = 0,35.22,4 = 7,84 lít
➝ V kk = 5.VO2 = 39,2 lít

a) Gọi số mol CH4, C2H2 là a, b (mol)
=> \(a+b=\dfrac{4,48}{22,4}=0,2\) (1)
\(n_{CaCO_3}=\dfrac{30}{100}=0,3\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a--->2a----------->a
2C2H2 + 5O2 --to--> 4CO2 + 2H2O
b------>2,5b-------->2b
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,3<-----0,3
=> a + 2b = 0,3 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> \(\%V_{CH_4}=\%V_{C_2H_2}=\dfrac{0,1}{0,2}.100\%=50\%\)
b) nO2 = 2a + 2,5b = 0,45 (mol)
=> VO2 = 0,45.22,4 = 10,08 (l)
=> Vkk = 10,08.5 = 50,4 (l)

\(n_{hh}=\dfrac{V_{hh}}{22,4}=\dfrac{1,68}{22,4}=0,075mol\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=x\\n_{C_2H_4}=y\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{CO_2\left(CH_4\right)}=x\\n_{CO_2\left(C_2H_4\right)}=2y\end{matrix}\right.\)
\(n_{CaCO_3}=\dfrac{m_{CaCO_3}}{M_{CaCO_3}}=\dfrac{10}{100}=0,1mol\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
x+2y x+2y ( mol )
Ta có:
\(\left\{{}\begin{matrix}22,4x+22,4y=1,68\\x+2y=0,1\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,025\end{matrix}\right.\)
\(\%CH_4=\dfrac{0,05}{0,075}.100=66,66\%\)
\(\%C_2H_4=100\%-66,66\%=33,34\%\)
\(m_{CH_4}=0,05.16=0,8g\)
\(m_{C_2H_4}=0,025.28=0,7g\)