Hòa tan 7,8 gam một kim loại R vào nước thu được 100ml dung dịch D và 2,24 lít H2 (đktc). Vậy R và nồng độ mol của dung dịch D là:
A. Na và 1M.
B. K và 2M.
C. K và 1M.
D. K và 1,5M.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Bài toán này có thể giải ngắn gọn như sau:
Số mol tạo ra = số mol H+ trung hòa = 2. Số mol H2
⇒ Số mol H2 = 0,075 : 2 = 0,00375 ⇒ V = 0,84 lít

Đáp án B
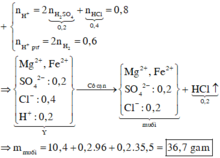
● Chú ý: Tiến hành cô cạn dung dịch chứa HCl, HNO3 thì các axit này sẽ bay hơi vì chúng có nhiệt độ sôi thấp.

Đáp án D
► Xử lý dữ kiện 200 ml dung dịch Y: nH+ = 0,2 × (0,2 + 0,15 × 2) = 0,1 mol.
pH = 13 ⇒ OH– dư ⇒ [OH–] = 1013 – 14 = 0,1M ⇒ nOH– dư = 0,4 × 0,1 = 0,04 mol.
||⇒ nOH–/Y = 0,04 + 0,1 = 0,14 mol ⇒ 400 ml dung dịch Y chứa 0,28 mol OH–.
► Dễ thấy nOH– = 2nH2 + 2nO/oxit ⇒ nO/oxit = (0,28 – 2 × 0,07) ÷ 2 = 0,07 mol.
||⇒ m = 0,07 × 16 ÷ 0,0875 = 12,8(g)
Đáp án B
Số mol H2 = 0,1 mol
Phương trình phản ứng:
Tính được M = m : n = 7,8 : 0,2 = 39. Vậy kim loại cần tìm là K.
C M = 0 , 2 0 , 1 = 2 M