Hợp chất A được tạo thành từ ion M+ và X2- có tổng số hạt là 116, trong A số hạt mang điện nhiều hơn số hạt không mang điện là 36. Mặt khác số khối của ion M+ nhỏ hơn số khối của ion X2- là 12. Tổng số hạt trong ion M+ ít hơn trong ion X2- là 17. Vậy A là:
A. Rb2S
B.Li2S
C. Na2S
D. K2S

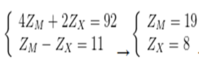
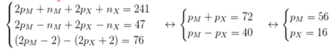
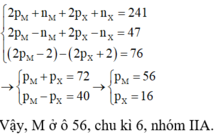


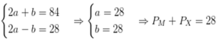
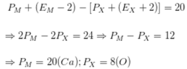
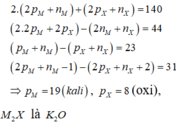
Cách 1
Gọi Z,N,E,Z',N',E' lần lượt là số p, n, e có trong nguyên tử M và X. Hợp chất A được tạo thành từ ion M+ và X2-.
Do đó A có dạng là
+ A có tổng số hạt là 116 nên
+ Trong A số hạt mang điện nhiều hơn số hạt không mang điện là 36:
+ Số khối của ion M+ lớn hơn số khối của ion X2- là 7:
+ Tổng số hạt trong ion M+ ít hơn trong ion X2- là 17:
Từ (1), (2), (3), (4) ta có:
Do đó M là Na và X là S A là Na2S.
Cách 2: Từ (1) và (2) (ở Cách 1) ta có: 4Z + 2Z' = 76
Đến đây ta chỉ việc thử đáp án để nhanh chóng tìm ra đáp án không cần thiết phải xét thêm 2 dữ kiện còn lại.
Cách 3: Quan sát đáp án ta nhận thấy cả bốn đáp án đều chứa S (Z = N = 16 )
Do đó X2- là S2-. Suy ra A là M2S
Đáp án C.