Xử lí 1,143 gam hỗn hợp rắn gồm kali clorua và kali sunfat bằng dung dịch axit sunfuric đặc, thu được 1,218 gam kali sunfat. Tính khối lượng của mỗi muối trong hỗn hợp rắn ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
![]()
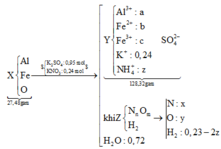
BTKL: mH2O = 27,48 + 0,95.98 + 0,24.101 – 128,32 – 0,2.17,7 = 12,96 gam⇒nH2O = 0,72 mol.
Vì nên Z phải có H2 ⇒ nH2 = 0,95 – 0,72 – 2z = 0,23 – 2z.
Bảo toàn N: x + z = 0,24
Mặt khác, mO.Z = 0,226. 3,54 = 0,8 gam ⇒ nO = y = 0,05 mol
Bảo toàn O: nO.X + 3.0,24 = 0,72 + y ⇔ nO.X = y = 0,05 mol ⇒ coi như oxi không oxh khử.
Khối lượng khí: 14x + 16y + 2. (0,23 – 2z) = 3,54

Bảo toàn điện tích:
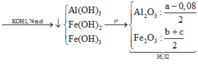
Cho KOH vào Y: OH- phân bổ  còn dư: 0,08 mol hòa tan Al(OH)3
còn dư: 0,08 mol hòa tan Al(OH)3
Vậy nAl(OH)3 = a – 0,08
⇒ hệ 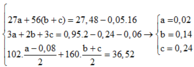
Vậy %mFe(OH)3 =53,90%

Đáp án A
Quy đổi E thành:
C2H3ON: 0,45 mol (tính từ mol KOH)
CH2: u mol
H2O: v mol
NH: p mol
Ta có: mE = 0,45.57 + 14u + 18v + 15p = 37 (1)
Đốt E tạo thành số mol CO2 bằng số mol H2O nên:
0,45.2 + u = 0,45.1,5 + u + v + 0,5p (2)
Khi đốt C2H4NO2K (a mol) và C3H6NO2K (b mol)
Ta có: nCO2 = 2a + 3b - (a+b)/2 = 2,25 mol
Và nH2O = 2a + 3b = 2,75 mol
Giải hệ trên ta có: a = 0,25 và b = 0,75
Suy ra x/y = a/b = 1/3
Đặt nGlyK = k ; nAlaK = 3k và nLysK = p mol
Bảo toàn nguyên tố N ta có: nN = k + 3k + 2p = 0,45 + p
Suy ra k = (0,45-p)/4
Bảo toàn nguyên tố C ta có: nC = 2k + 3.3k + 6p = 0,45.2 + u
Suy ra k = (u-6p+0,9)/11
Do đó: (0,45-p)/4 = (u-6p+0,9)/11 (3)
Giải hệ (1), (2), (3) ta có: u = 0,5; v = 0,2 và p = 0,05
Vậy nKOH = x+ y+z = 0,45 mol ; nCH2 = y+4z = 0,5 mol ; nNH = z = 0,05 mol
Giải ra x = 0,1 ; y = 0,3 và z = 0,05
Suy ra %mAlaK = 65,02% gần nhất với giá trị 65%.

a) Gọi số mol CH3COOH, C2H5OH là a, b (mol)
=> 60a + 46b = 25,8 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Na + 2CH3COOH --> 2CH3COONa + H2
a------------------------->0,5a
2Na + 2C2H5OH --> 2C2H5ONa + H2
b--------------------->0,5b
=> 0,5a + 0,5b = 0,25 (2)
(1)(2) => a = 0,2 (mol); b = 0,3 (mol)
=> \(\left\{{}\begin{matrix}\%m_{CH_3COOH}=\dfrac{0,2.60}{25,8}.100\%=46,51\%\\\%m_{C_2H_5OH}=\dfrac{0,3.46}{25,8}.100\%=53,49\%\end{matrix}\right.\)
b)
\(n_{CH_3COOC_2H_5}=\dfrac{13,2}{88}=0,15\left(mol\right)\)
PTHH: CH3COOH + C2H5OH --H2SO4(đ),to--> CH3COOC2H5 + H2O
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\) => Hiệu suất tính theo CH3COOH
PTHH: CH3COOH + C2H5OH --H2SO4(đ),to--> CH3COOC2H5 + H2O
0,15<---------------------------------0,15
=> \(H=\dfrac{0,15}{0,2}.100\%=75\%\)

Đáp án B
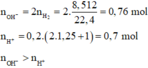
=> Kết tủa chứa BaSO4 và Al(OH)3.
• Có 24 , 86 + 30 , 08 = m KL + m OH - trong Al ( OH ) 3 + m SO 4 2 - + m Cl -
=> m + 17(0,76 - 0,7) + 96.0,25 + 35,5.0,2 = 54,94 g
=> m = 22,82 g
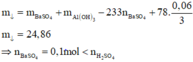
=> Chứng tỏ Ba2+ tạo kết tủa hoàn toàn: n Ba = 0 , 1 mol
![]()

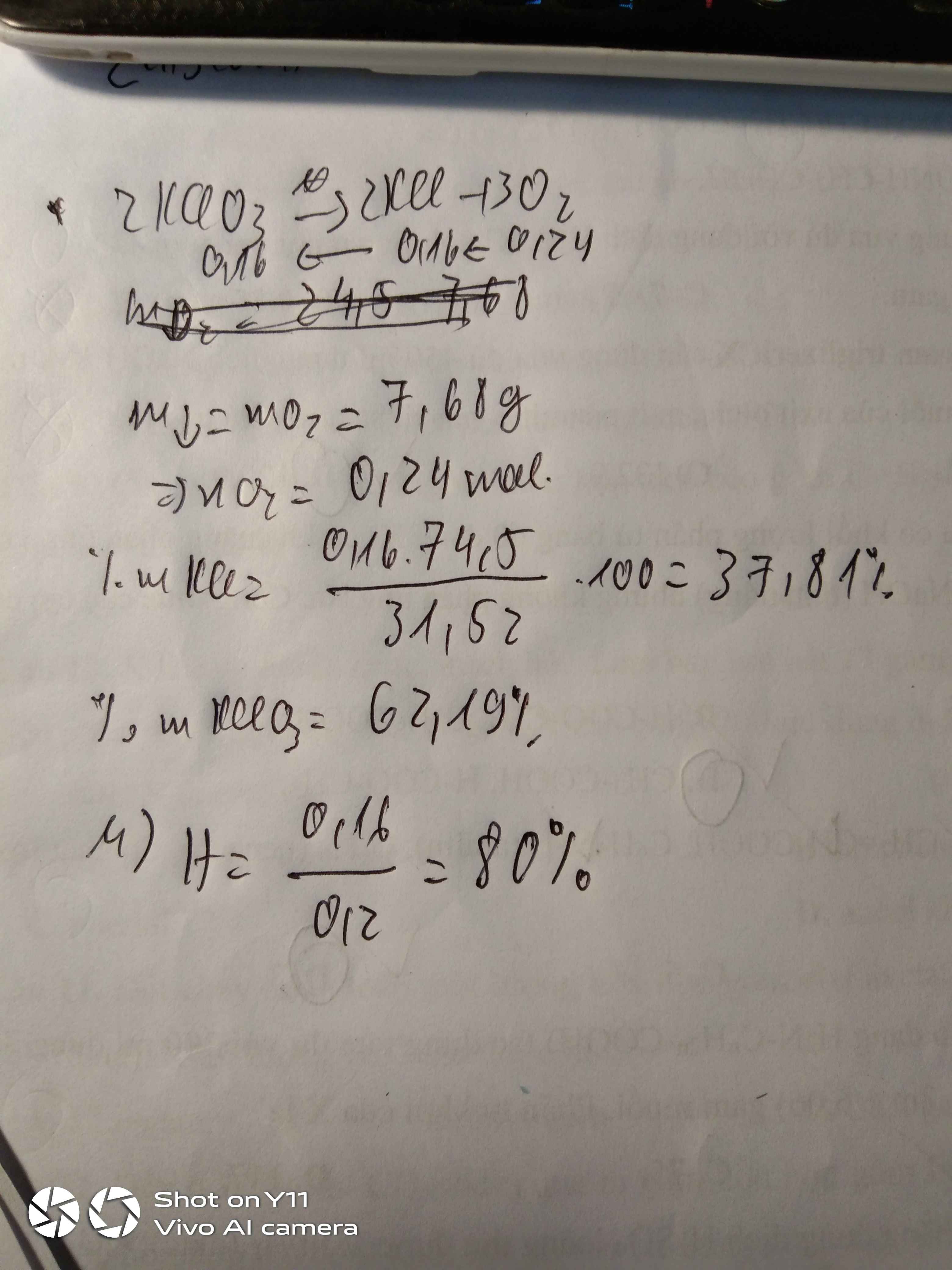
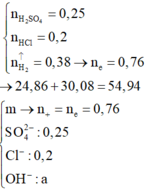
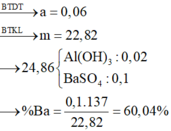
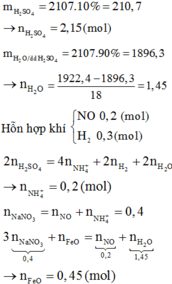
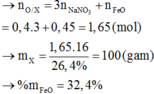
Khối lượng muối trong hỗn hợp :
Đặt x và y là số mol KCl và K 2 SO 4 trong hỗn hợp. Ta có
74,5x + 174y = 1,14 (1)
Khối lượng K 2 SO 4 sau phản ứng bao gồm khối lượng K 2 SO 4 vốn có trong hỗn hợp ban đầu và khối lượng K 2 SO 4 sinh ra sau phản ứng (m = 174.0,5x = 87x). Ta có :
87x+ 174y= 1,218 (2)
Giải hệ phương trình (1) và (2), được x = 0,006 ; y = 0,004.
Khối lượng KCl là : 74,5.0,006 = 0,447 (g).
Khối lượng K 2 SO 4 là : 1,143 - 0,447 = 0,696 (g).