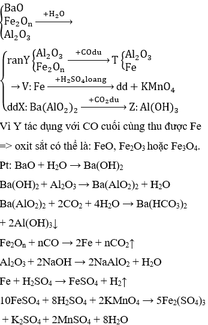Cho 18,4g hỗn hợp gồm Fe và một kim loại A hoá trị II tác dụng với H 2 S O 4 loãng, dư thì được 2,24 lít khí (dktc) và 12,8g chất rắn không tan. Hòa tan hoàn toàn phần chất rắn không tan bằng H2SO4 đặc, đun nóng thì được 12,8g khí S O 2 . Xác định tên của kim loại A (Ca=40, Fe=56, Mg=24, Cu=64, S=32, O=16)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

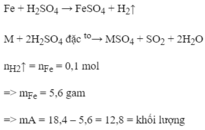


Chuyển đổi hết từ khối lượng chất sang mol chất, rồi viết phương trình phản ứng , tính từng bước theo phương trình hóa học sẽ ra được.

PTHH: \(Al+NaOH+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(\Rightarrow n_{Al}=0,09\left(mol\right)\) \(\Rightarrow\%m_{Al}=\dfrac{0,04\cdot27}{2,6}\cdot100\%\approx41,54\%\)
Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+64b=2,6-0,04\cdot27=1,52\) (1)
Mặt khác: \(n_{NO}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
Bảo toàn electron: \(3a+2b=0,075\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Fe}=0,022\left(mol\right)\\b=n_{Cu}=0,0045\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,022\cdot56}{2,6}\cdot100\%\approx47,38\%\\\%m_{Cu}\approx11,08\%\end{matrix}\right.\)

Vì Ag không tác dụng với H2SO4 loãng
Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,3 0,45
\a) Chất rắn không tan là Ag nên :
\(m_{Ag}=5,4\left(g\right)\)
⇒ \(m_{Al}=13,5-5,4=8,1\left(g\right)\)
0/0Al = \(\dfrac{8,1.100}{13,5}=60\)0/0
0/0Ag = \(\dfrac{5,4.100}{13,5}=40\)0/0
b) Có : \(m_{Al}=8,1\left(g\right)\)
\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_{H2}=\dfrac{0,3.3}{2}=0,45\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,45.22,4=10,08\left(l\right)\)
Chúc bạn học tốt

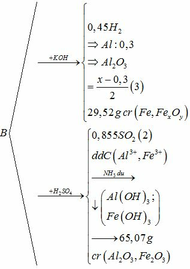
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
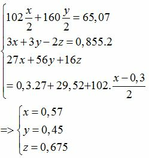
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
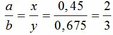
=> Fe2O3