Kim loại nào sau đây được dùng để nhận biết cả 4 dung dịch sau: HCl, H 2 S O 4 loãng, C u C l 2 , C u S O 4 ?
A. Ba
B. Mg
C. Fe
D. Ag
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

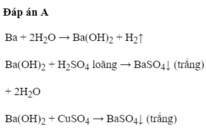
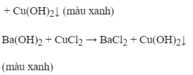

Đáp án cần chọn là: C
- dùng quỳ tím
+ nhóm (I) làm quỳ chuyển xanh: Na2CO3, NaOH
+ quỳ chuyển đỏ: HCl
+ quỳ không đổi màu: Na2SO4
- Cho HCl vào từng chất nhóm (I), chất xuất hiện khí là Na2CO3, không hiện tượng là NaOH

1 B , 2 C , 3 B
4) Fe + H2SO4 ---> FeSO4 + H2
- nFe = 11,2 / 56 = 0,2 mol
theo PTHH : nH2 = nFe = 0,2 mol
VH2(đktc) = 0,2 x22,4=4,48 (l)
Vậy ....
câu1
2Fe + 3Cl2 -----> 2FeCl3
FeCl3 + 3NaOH ------> Fe(OH)3 + 3NaCl
2Fe(OH)3 ----to--> Fe2O3 + 3H2O
Fe2O3 +3 H2SO4 -----> Fe2(SO4)3 + 3H2O
câu 3 phần bài tập
nH2 = 11,2/22,4=0,5mol
Cu không phản ứng với HCl chỉ có Fe phản ứng
pt : Fe + HCl -----> FeCl2 + H2
n pứ: 0,5<----------------------0,5
mFe = 0,5.56=28g
mCu = mhh - mFe = 40 - 28 =12g
%mFe = \(\dfrac{28}{40}.100\%=70\%\)
%mCu = 100% - 70% = 30%

Bài 4 :
a)
\(R+2HCl\rightarrow RCl_2+H_2\)
m dd tăng=mR-mH2
\(\rightarrow m_{H2}=0,05\left(mol\right)\)
\(\rightarrow n_{H2}=\frac{0,5}{2}=0,025\left(mol\right)\)
\(n_Rn_{H2}=0,025\left(mol\right)\)
\(M_R=\frac{0,6}{0,025}=24\left(\frac{g}{mol}\right)\)
Vậy R là Magie
b)
\(n_{HCl}=0,025.2=0,05\left(mol\right)\)
\(m_{dd_{HCl}}=\frac{0,05.36,5}{18,25\%}=10\left(g\right)\)
\(m_{Dd_{Spu}}=0,6+10-0,025.2=10,55\left(g\right)\)
\(\rightarrow C\%_{MgCl2}=\frac{0,025.95}{10,55}.100\%=22,51\%\)
Bài 5 :
\(C\%=\frac{m_{HCl}}{m_{dd}}.100\%=10=\frac{m_{HCl}}{185,4}.100\%\)
\(\rightarrow m_{HCl}=18,54\left(g\right)\)
Gọi số mol HCl thêm vào = x (mol)
\(16,57\%=18,54+36,5x/185,4.100\%\)
\(\rightarrow x=0,4\left(mol\right),V_{HCl}=0,4.22,4=8,96\left(l\right)\)

1) -Cho QT vào
+Làm QT hóa đỏ là HCl và H2SO4
+Làm QT hóa xanh là NaOH
+Ko làm QT đổi màu là BaCl2
-Cho BaCl2 vào HCl và H2SO4
+Tạo kết tủa là H2SO4
H2SO4+BaCl2----->2HCl+BaSO4↓
+Không có ht là HCl
2) a)-Cho QT vào
+Làm QT hóa xanh là NaOH
+Làm QT hóa đỏ là HCl
+Không làm QT đổi màu là NaNO3 và NaCl
+Cho dd AgNO3 vào NaCl và NaNO3
+Có kết tủa là NaCl
AgNO3+NaCl---->AgCl+NaNO3
+K có ht là NaNO3
b) -Cho QT vào
+Làm QT hóa xanh là KOH
+k làm QT đổi màu là K2SO4 , K2CO3, KNO3(N1)
-Cho dd HCl vào N1
+ Tạo khí là K2CO3
K2CO3+2HCl---->2KCl+H2O+CO2
+Ko có ht là K2SO4 và KNO3(N2)
-Cho BaCl2 vào N2
+Tạo kết tủa là K2SO4
K2SO4+BaCl2---->BaSO4+2KCl
+K có ht là KNO3
3)a) -Cho H2SO4 vào
Tạo kết tủa trắng là Ba(OH)2
Ba(OH)2+H2SO4---->2H2O+BaSO4
+Không có ht kaf Cu(OH)2 và Na2CO3(n1)
-Cho Ba(OH)2 vào N1
+Tạo kết tủa là Na2CO3
Na2CO3+Ba(OH)2---->2NaOH+BaCO3
+K có ht là Cu(OH)2
b)-Cho nước trong dd vào trước
+Tan là NaCl, Na2CO3(N1)
+K tan là BaSO4,BaCO3(N2)
-Cho H2SO4 vào N1
+Tạo khí là Na2CO3
H2SO4+Na2CO3--->BaSO4+H2O+CO2
+ Không có ht là ,NaCl
+Cho H2SO4 vào N2
+Có kết tủa và khí là BaCO3
BaCO3+H2SO4--->BaSO4+H2O+CO2
+K có ht là BaSO4
4) -Cho qua HCl
+Tạo khí là Al, Zn
2Al+6HCl---->2AlCl3+3H2
Zn+2HCl---->ZnCl2+H2
+K có ht là Cu
-Cho Al và Zn qua dd NaOH dư
+Tạo khí là Al
2Al+2NaOH+2H2O----->2NaAlO2+3H2

Câu 3:
Đătl số mol của Na ; Al; Fe mỗi phần là: x; y; z
* Phần I:
nH2= 0,2 mol
PTHH:
\(\text{2Na+2H2O→ 2NaOH+ H2}\)
x___________x_____0,5x
\(\text{2NaOH+ 2Al+2H2O→ 2NaAlO2+ 3H2}\)
x______________________________1,5x
\(\text{⇒ 2x= 0,2}\)
\(\text{⇒ x= 0,1 mol}\)
*Phần II:
nHCl= 1,2 mol
nH2= 0,5 mol
nNaOH= 1,2 mol
PTHH:
\(\text{2Na+ 2HCl→ 2NaCl+ H2}\)
0,1__________________0,05
\(\text{2Al+ 6HCl→ 2AlCl3+ 3H2}\)
y___________________1,5y
\(\text{Fe+2HCl→ FeCl2+ H2}\)
z__________________z
\(\text{HCl+ NaOH→ NaCl+ H2O}\)
0,2___0,2
\(\text{FeCl2+ 2NaOH→ Fe(OH)2↓+ 2NaCl}\)
z________ z___________z
\(\text{AlCl3+ 3NaOH→ Al(OH)3↓+ 3NaCl}\)
y______3y_________3y
\(\text{NaOH+ Al(OH)3→ NaAlO2+ H2O}\)
\(\text{2Fe(OH)2+1/2O2→ Fe2O3 +2H2O}\)\(\text{2Al(OH)3→ Al2O3+ 3H2O }\)
\(\text{⇒ nNaOH= nHCl dư+ 2nFeCl2+4nAl(Cl3)-nAl(OH)3}\)
⇒nAl(OH)3= 4y+2z-1
+ Ta có hệ pt:
\(\left\{{}\begin{matrix}1,5y+z=0,45\\\frac{\left(4y+2z-1\right).102}{2+80z}=17,1\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}x=0,2\\z=0,15\end{matrix}\right.\)
⇒%Na= \(\frac{0,1.23}{0,1.23+0,2.27+0,15.56}\text{ .100%=14,29%}\)
⇒% Al=\(\frac{0,2.27}{16,1}\text{ .100%=33,54%}\)
\(\text{⇒%Fe=52,17 %}\)

a) cho Ba +H2O trong dung dịch tạo thành Ba(OH)2
- cho Ba(OH)2 + FeCl2-> kết tủa trắng xah
Ba(OH)2 + FeCl3-> ket ủa đỏ nâu
Ba(OH)2+ AlCl3-> kết tủa trắng xanh
Ba(OH)2+ NH4Cl-> có mùi khai
Ba(OH)2+ BaCl2-> không phẩn ứng
| hoá chất | MgSO4 | NaNO3 | KOH | BaCl2 | Na2SO4 |
| thuốc thử | |||||
| phenolphtalein | ------ | ------ | màu đỏ | ------ | -------- |
| MgSO4 | ------- | ------- | đã nhận biết | -------- | ------- |
| NaNO3 | ------- | ------ | đã nhận biết | ------- | -------- |
| KOH |
Mg(OH)2 không tan |
------- | đã nhận biết | ----- | ------- |
| BaCl2 | đã nhận biết | --------- | đã nhận biết | ----- | BaSO4\(\downarrow\) |
| Na2SO4 | đã nhận biết | ------ | đã nhận biết | BaSO4\(\downarrow\) | đã nhận biết |
pt: MgSO4 +2KOH ---> Mg(OH)2 + K2SO4
BaSO4 + Na2SO4 -----> BaSO4\(\downarrow\) + Na2SO4