Cần bao nhiêu mol M n O 2 tác dụng với lượng dư HCl đặc, đun nóng để thu được 5,6 lít khí clo ở đktc?
A. 0,20.
B. 0,25.
C. 0,10.
D. 0,15.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

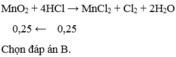

\(a) Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = n_{Fe} = \dfrac{5,6}{56} = 0,1(mol)\\ \Rightarrow V_{H_2} = 0,1.22,4 = 2,24(lít)\\ b) n_{O_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ \dfrac{n_{H_2}}{2} = 0,05 < \dfrac{n_{O_2}}{1} = 0,3 \to O_2\ dư\\ n_{H_2O} = n_{H_2} = 0,1(mol) \Rightarrow m_{H_2O} = 0,1.18 = 1,8(gam)\)

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g

1)
- Xét phần 1:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,2<-------------------0,2
=> nFe = 0,2 (mol)
- Xét phần 2:
\(n_{SO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,2-->0,6-------->0,1--------->0,3
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,3<----0,6<------0,3<-----0,3
=> nCu = 0,3 (mol)
m = 2.(0,2.56 + 0,3.64) = 60,8 (g)
2)
\(m_{H_2SO_4\left(bđ\right)}=\dfrac{200.98}{100}=196\left(g\right)\)
=> \(m_{H_2SO_4\left(sau.pư\right)}=196-98\left(0,6+0,6\right)=78,4\left(g\right)\)
mdd sau pư = \(\dfrac{60,8}{2}+200-0,6.64=192\left(g\right)\)
\(\left\{{}\begin{matrix}C\%_{\left(Fe_2\left(SO_4\right)_3\right)}=\dfrac{0,1.400}{192}.100\%=20,83\%\\C\%_{\left(CuSO_4\right)}=\dfrac{0,3.160}{192}.100\%=25\%\\C\%_{\left(H_2SO_4.dư\right)}=\dfrac{78,4}{192}.100\%=40,83\%\end{matrix}\right.\)

\(n_{Cu}=a\left(mol\right),n_{Fe}=b\left(mol\right),n_{Al}=c\left(mol\right)\)
\(m_X=64a+56b+27b=35.7\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{21.84}{22.4}=0.975\left(mol\right)\)
\(Cu+Cl_2\underrightarrow{^{^{t^0}}}CuCl_2\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}FeCl_3\)
\(Al+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}AlCl_3\)
\(n_{Cl_2}=a+1.5b+1.5c=0.975\left(mol\right)\left(2\right)\)
\(n_{hh}=ka+kb+kc=0.25\left(mol\right)\)
\(n_{H_2}=kb+k\cdot1.5c=0.2\left(mol\right)\)
\(\Leftrightarrow a-0.25b-0.875c=0\left(3\right)\)
\(\left(1\right),\left(2\right),\left(3\right):a=0.3,b=0.15,c=0.3\)
\(\%Cu=\dfrac{0.3\cdot64}{35.7}\cdot100\%=53.78\%\)
\(\%Fe=\dfrac{0.15\cdot56}{35.7}\cdot100\%=23.52\%\)
\(\text{%Al=22.7%}\)

a)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,075<--0,15--->0,075-->0,075
=> m = 0,075.24 = 1,8 (g)
b) VH2 = 0,075.22,4 = 1,68 (l)
c) mMgCl2 = 0,075.95 = 7,125 (g)
d)
PTHH: 2H2 + O2 --to--> 2H2O
0,075->0,0375
=> VO2 = 0,0375.22,4 = 0,84 (l)
a.b.c.
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,075 0,15 0,075 0,075 ( mol )
\(m_{Mg}=0,075.24=1,8g\)
\(V_{H_2}=0,075.22,4=1,68l\)
\(m_{MgCl_2}=0,075.95=7,125g\)
d.\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,075 0,0375 ( mol )
\(V_{O_2}=0,0375.22,4=0,84l\)