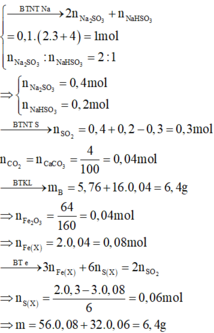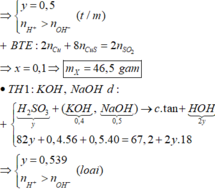Cho một luồng không khí có chứa các hợp chất: hơi nước, H2S, CO2 qua các dung dịch NaOH đặc, H2SO4 đặc. Sau khi hợp chất đã bị hấp thụ hết, thu được một hỗn hợp khí A. So sánh tính chất lí hoá của các khí trong hỗn hợp A. Viết các phản ứng xảy ra.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nung hỗn hợp BaCO3, Cu, FeO chỉ có BaCO3 bị nhiệt phân hủy
BaCO3 → t ∘ BaO + CO2↑ (B)
Rắn A gồm: Cu, FeO, BaO, có thể có BaCO3 dư
Khí B là CO2
CO2 + KOH → KHCO3
CO2 + 2KOH → K2CO3 + H2O
Dung dịch C gồm KHCO3 và K2CO3
KHCO3 + NaOH → K2CO3 + Na2CO3 + H2O
K2CO3 + CaCl2 → CaCO3↓ + 2KCl
A + H2O dư có phản ứng xảy ra:
BaO + H2O → Ba(OH)2
Vây dd D là Ba(OH)2
rắn E là Cu, FeO, có thể có BaCO3 dư
E + HCl dư → khí B + dd F + rắn G
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
FeO + 2HCl → FeCl2 + H2O
Dd F gồm: BaCl2, FeCl2 và HCl dư
Rắn G là Cu
A + H2SO4 đặc => hỗn hợp khí H ( từ đây khẳng định chắc chắn A có BaCO3 dư)
BaCO3 + H2SO4 đặc → t ∘ BaSO4↓ + CO2 + H2O
Cu + 2H2SO4 đặc → t ∘ CuSO4 + SO2↑ + 2H2O
2FeO + 4H2SO4 đặc → t ∘ Fe2(SO4)3 + SO2 + 4H2O
Hỗn hợp khí H gồm: SO2 và CO2
Dung dịch I gồm: CuSO4, Fe2(SO4)3, H2SO4 đặc, nóng dư
Kết tủa K là: BaSO4.

a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + 2H_2O$
$n_{Cu} = n_{SO_2} = \dfrac{1,12}{22,4} = 0,05(mol)$
$\%m_{Cu} = \dfrac{0,05.64}{10}.100\% = 32\%$
$\%m_{CuO} = 100\% -32\% = 68\%$
b)
$NaOH + SO_2 \to NaHSO_3$
$n_{NaOH} = n_{SO_2} = 0,05(mol)$
$V_{dd\ NaOH} = \dfrac{0,05}{2} = 0,025(lít) = 25(ml)$

Đáp án C
Gọi công thức phân tử của A là CxHyOz
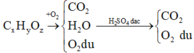
![]()
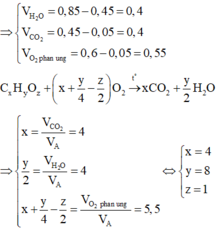
Vậy công thức phân tử của A là C4H8O