Khử 48 gam đồng(II) oxit bằng khí hiđro. Hãy:
a) Tính khối lượng đồng thu được.
b) Tính thể tích khí hiđro (đktc) cần dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



nCuO = 48 : 80 = 0,6 (Mol)
pthh : CuO + H2 -t--> Cu + H2O
0,6---->06------>0,6
=> mCu= 0,6 . 64 = 38,4 (G)
=> VH2 = 0,6 .22,4 = 13,44 (L)
a, \(n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
0,6 0,6 0,6
\(\rightarrow\left\{{}\begin{matrix}m_{Cu}=0,6.64=38,4\left(g\right)\\V_{H_2}=0,6.22,4=13,44\left(l\right)\end{matrix}\right.\)

\(n_{CuO}=\dfrac{9,6}{80}=0,12mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,12 0,12 0,12
a)\(m_{Cu}=0,12\cdot64=7,68g\)
b)\(V=0,12\cdot22,4=2,688l\)

nCuO = 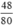 = 0,6 mol.
= 0,6 mol.
Phương trình hóa học của phản ứng khử CuO:
CuO + H2 → Cu + H2O.
nCu = 0,6mol.
mCu = 0,6 .64 = 38,4g.
Theo phương trình phản ứng trên:
nH2 = 0,6 mol
VH2 = 0,6 .22,4 = 13,44 lít.

1/ \(CuO+H_2-^{t^o}\rightarrow Cu+H_2O\)
\(n_{Cu}=n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
=> \(m_{Cu}=0,6.64=38,4\left(g\right)\)
\(n_{H_2}=n_{CuO}=0,6\left(mol\right)\)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
2. \(2H_2+O_2-^{t^o}\rightarrow2H_2O\)
\(n_{H_2}=0,375;n_{O_2}=0,125\)
Lập tỉ lệ \(\dfrac{0,375}{2}>\dfrac{0,125}{1}\)
=> Sau phản ứng H2 dư, tính theo số mol O2
\(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\)
=> \(m_{H_2O}=0,25.18=4,5\left(g\right)\)

nCu = 8: 80=0,1(mol)
a) PTHH : CuO + H2 -t--> Cu +H2O
0,1-> 0,1------>0,1(mol)
mCu = 0,1.64=6,4(g)
VH2 = 0,1.22,4=2,24(l)

3.
nHgO = 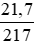
Phương trình hóa học của phản ứng khử HgO:
HgO + H2 → Hg + H2O
nHg = 0,1 mol.
mHg = 0,1 .201 = 20,1g.
nH2 = 0,1 mol.
VH2 = 0,1 .22,4 =2,24l.
1.
Phương trình phản ứng:
Fe3O4 + 4H2 → 4H2O + 3Fe
HgO + H2 → H2O + Hg
PbO + H2 → H2O + Pb

\(m_{CuO}=50.20\%=10\left(g\right)\)
\(n_{CuO}=\dfrac{10}{80}=0,125\left(mol\right)\)
\(m_{Fe_2O_3}=50-10=40\left(g\right)\)
\(n_{Fe_2O_3}=\dfrac{40}{160}=0,25\left(mol\right)\)
PTHH :
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,125 0,125 0,125
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
0,25 0,75 0,5
\(a,V_{H_2}=\left(0,75+0,125\right).22,4=19,6\left(l\right)\)
\(b,m_{Cu}=0,125.64=8\left(g\right)\)
\(m_{Fe}=0,5.56=28\left(g\right)\)

\(n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\\
pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,6 0,6 0,6 0,6
\(m_{Cu}=0,6.64=38,4g\\
V_{H_2}=0,6.22,4=13,44L\)