thực hiền cho biết nguyên tố Natri chiếm 59 phần trăm về khối lượng trong hợp chất lưu huỳnh .hãy viết công thức hóa học và tính phân tử khối trong hợp chất của lưu huỳnh và Oxi ,lưu huỳnh chiếm 50 phần trăm về khối lượng . hãy xác định phân tử khối của hợp chất
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi công thức của hợp chất là N a x S y .
Theo đề bài, ta có:
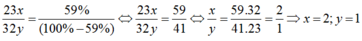
Vậy công thức của hợp chất là: N a 2 S .
Phân tử khối: 2 . 23 + 32 = 78đvC.

Gọi CTPT của hợp chất là NaxS
Ta có:
\(\frac{23x}{23x+32}.100\%=59\%\)
\(\rightarrow x=2\)
Vậy CTPT là Na2S.
MNa2S=2.23+32=78

Gọi ct chung: \(H^I_xS^{II}_y\)
Theo qui tắc hóa trị: `I.x = II.y =>`\(\dfrac{x}{y}=\dfrac{II}{I}\)
`-> x=2, y=1`
`-> CTHH: H_2S`
\(K.L.P.T_{H_2S}=1.2+32=34< amu>.\)
\(\%H=\dfrac{1.2.100}{34}\approx5,88\%\)
`%S = 100%-5,88% =94,12%`

Gọi công thức của hợp chất là NaxSy . Theo đề bài,ta có:
\(\dfrac{xx23}{yx32}\) = \(\dfrac{59\%}{\left(100-59\right)\%}\) \(\rightarrow\) \(\dfrac{xx23}{yx32}\) = \(\dfrac{59}{41}\)
\(\rightarrow\) \(\dfrac{x}{y}\) = \(\dfrac{59x32}{41x23}\) = \(\dfrac{1888}{943}\) \(\approx\) \(\dfrac{2}{1}\)
Vậy x = 2 ; y = 1.
Công thức hóa học của hợp chất : Na2S.
Phân tử khối bằng: 2 x 23 + 32 = 78 (đvC).
Good luck!!!

a)
- Hợp chất được cấu tạo từ các nguyên tố Ca, C và O
- Trong đó có 1 nguyên tử Ca, 1 nguyên tử C và 3 nguyên tử O
- PTK: 100 đvC
b)
\(\%P=\dfrac{31\cdot2}{142}\cdot100\%\approx43,66\%\)
c)
Gọi công thức cần tìm là SxOy
Ta có: \(\dfrac{32x}{32x+16y}=\dfrac{40}{100}\) \(\Rightarrow\dfrac{x}{y}=\dfrac{1}{3}\)
\(\Rightarrow\) CTHH cần tìm là SO3

a) MA = 32.2 = 64(g/mol)
\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=64-32=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2
b) MA = 2.17 = 34 (g/mol)
\(m_H=\dfrac{34.5,88}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
\(m_S=34-2=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
=> CTHH: H2S

Công thức hóa học: S x O y
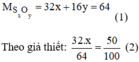
Giải phương trình (2) ta được: x = 1 thay vào pt (1) ⇒ y = 2.
Vậy công thức hóa học của oxit là S O 2

Câu 1 :
\(M_{K_2CO_3}=39.2+12+16.3=138\left(dvC\right)\)
\(\%K=\dfrac{39.2}{138}.100\%=56,52\%\)
\(\%C=\dfrac{12}{138}.100\%=8,69\%\)
\(\%O=100\%-56,52\%-8,69\%=34,79\%\)
Còn lại cậu làm tương tự nhá

\(M_A=\dfrac{1}{\dfrac{0,28}{22,4}}=80\left(g/mol\right)\)
\(m_S=\dfrac{40.80}{100}=32\left(g\right)\Rightarrow n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=80-32=48\left(g\right)\Rightarrow n_O=\dfrac{48}{16}=3\left(mol\right)\)
=> CTHH: SO3

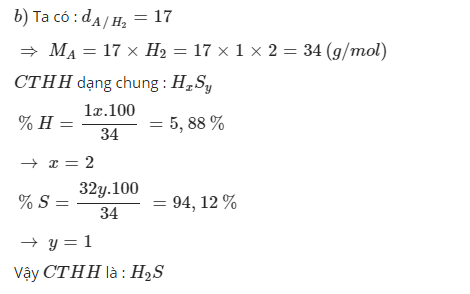
Đặt CTHH của hợp chất là NaxSyNaxSy
Theo bài ra :
x:y=%MNa23:%MS32=59%23:41%32=2:1x:y=%MNa23:%MS32=59%23:41%32=2:1
Vậy CTHH của hợp chất là Na2SNa2S
PTK=2.23+32=78(ĐvC)
Theo để, suy ra %mS = 100% - 59% = 41%
Đặt CTHH là NaxSy
=> x : y = 5923:4132=2,56:1,28=2:15923:4132=2,56:1,28=2:1
=> CTHH: Na2S