Cho 150ml dd chứa hỗn hợp NaOH 2M và Ba(OH)2 0,5M vào 100 ml dd Al2(SO4)3 0,6M. Pư kết thúc thu đc kết tủa , nung kết tủa đến khối lượng ko đổi thì thu đc m gam chất rắn . Giá trị của m là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1.
Các PTPƯ có thể xảy ra theo thứ tự sau:
Gọi số mol Mg và Fe có trong hỗn hợp Q lần lượt là: x và y (mol) Mg + 2AgNO3→ Mg(NO3)2 + 2Ag ↓ (1)
Fe + 2AgNO3→ Fe(NO3)2 + 2Ag ↓ (2)
Fe(NO3)2 + AgNO3→ Fe(NO3)3 + Ag (3)
Theo đề bài ta có: \(\dfrac{6,44}{56}\) = 0,115 < nQ = x + y < \(\dfrac{6,44}{24}\)= 0,2684 (mol)
* Giả sử phản ứng (3) có xảy ra thì chất rắn A chỉ là Ag. Vậy:
nAg > 2x + 2y > 2.0,115 = 0,23 ->mAg > 24,84 > 24,36 (loại)
Vậy: Không xảy ra phản ứng (3). Xét các trường hợp sau:
TH1: Không có (2) suy ra sau (1) dd AgNO3 hết. Chất rắn A gồm Ag, Fe, Mg (có thểdư); dung dịch B chỉ có Mg(NO3)2
Mg(NO3)2→ Mg(OH)2→ MgO. Theo đề 7,0 gam chất rắn là MgO
=> nMgO = nMg(OH)2 = nMg(NO3)2 (l) = 0,175 mol
->nAg(l) = 0,175.2 = 0,35 mol
-> mA > mAg (l) = 0,35 . 108 = 37,8 > 24,36 (loại)
TH2: Có phản ứng (2): Fe pư một phần. (vì nếu Fe hết thì mA>24,84). Gọi số mol Fe phản ứng ở (2) là z mol thì: Chất rắn A thu được gồm: Ag (2x + 2z mol); Fe dư (y - z mol). Dung dịch B gồm: Mg(NO3)2 x mol; Fe(NO3)2 z mol.
Theo đề:
Mg(NO3)2→ Mg(OH)2→ MgO
x → x → x (mol)
Fe(NO3)2 → Fe(OH)2 →+O2; nhiệt độ→ 1/2Fe2O3
z → z → 0,5z (mol)
Vậy ta có hệ phương trình sau:
+ 24x+ 56y = 6, 44
+ 108(2x + 2z) + 56(y+z)=24,36
+ 40x+ 160 . 0,5z = 7
Giải hệ ta đc:
x = 0,035 ; y = 0,1 ; z = 0,07
=> mMg = 0,025 . 24 = 0,84 g ; mFe = 0,1 . 56 = 5,6 g
* Vậy trong Q
%mMg = 0, 84 : 6, 44x100%= 13, 04%; %mFe = 100% - 13, 04% = 86, 96%
* Theo (1), (2) ta có:
nAgNO3 = 2x + 2z = 0,21 mol -> [AgNO3] = p = 0,21 / 0,5 = 0,42M
(gần 1 tiếng của mik đó :( lần sau mấy bài nâng cao này bn nên cho bài chỗ nâng cao ý...cho mấy bác cao trình hơn giải cho :< )

Nhận thấy 3 < nOH- : nAl3+ = 1,4 : 0,4 < 4 → xảy ra quá trình hòa tan kết tủa
Al3+ + 3OH- → Al(OH)3↓
x------3x
Al3+ + 4OH- → Al(OH)4-
y-------4y
Ba2+ + SO42- → BaSO4↓
0,7-----0,6------->0,6
Ta có hệ 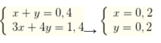
Vậy kết tủa gồm nAl(OH)3 = 0,2 mol, nBaSO4 = 0,6 mol
Nung kết tủa đến khối lượng không đổi: Al2O3: 0,1 mol và nBaSO4 = 0,6 mol → mchất rắn = 150 gam.
Đáp án A

nNa = mNa : MNa = 36,8 : 23 = 1,6 (mol)
\(\text{nFe2(SO4)3 = 0,4.0,25 = 0,1 (mol)}\)
\(\text{nAl2(SO4)3 = 0,4.0,5 = 0,2 (mol)}\)
PTHH: 2Na + 2H2O \(\rightarrow\) 2NaOH + H2 (1)
_______1,6 __________1,6__________(mol)
Theo PTHH (1):\(\text{ nNaOH = nNa = 1,6 (mol)}\)
Ta thấy \(\text{nNaOH = 1,6 (mol) < 6 (nFe2(SO4)3 + nAl2(SO4)3)}\) do vậy NaOH không đủ để kết tủa hết ion Fe3+ và Al3+ về dạng Fe(OH)3 và Al(OH)3
NaOH sinh ra sẽ phản ứng đồng thời với Fe2(SO4)3 và Al2(SO4)3 theo tỉ lệ của chúng trong hh dd
Có nFe2(SO4)3 : nAl2(SO4)3 = 0,01 : 0,02 = 1 : 2
Đặt nFe2(SO4)3 = x (mol) => nAl2(SO4)3 = 2x (mol)
6NaOH + Fe2(SO4)3\(\rightarrow\)2Fe(OH)3↓+ 3Na2SO4 (2)
6x_________x _________2x ___________________(mol)
6NaOH + Al2(SO4)3 \(\rightarrow\) 2Al(OH)3↓+ 3Na2SO4 (3)
12x ______2x____________4x _________________ (mol)
Tổng mol NaOH pư ở (2) và (3) là:\(\text{ 6x + 12x = 18x (mol)}\)
\(\rightarrow\) 18x = 1,6
\(\rightarrow\)x =\(\frac{4}{45}\) (mol)
Vậy kết tủa thu được gồm: Fe(OH)3:\(\frac{8}{45}\) (mol) và Al(OH)3: \(\frac{16}{45}\)(mol)
Nung kết tủa xảy ra phản ứng
2Fe(OH)3\(\rightarrow\) Fe2O3 + 3H2O (4)
\(\frac{8}{45}\)_________\(\frac{2}{45}\) (mol)
2Al(OH)3\(\rightarrow\) Al2O3 + 3H2O
\(\frac{16}{45}\)_________ \(\frac{8}{45}\) (mol)
Vậy rắn thu được sau khi nung kết tủa gồm
Fe2O3: \(\frac{2}{45}\) (mol) và Al2O3: \(\frac{8}{45}\) (mol)
\(\rightarrow\)m rắn = \(\frac{2}{45}\).160 + \(\frac{8}{45}\).102 =25,24 (g)



m=1,53g?