Bai 2/49/sgk hoa hoc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) (1) Fe + 2FeCl3 → 3FeCl2
(2) 3Ba(OH)2 + 2FeCl3 → 3BaCl2+ 2Fe(OH)3↓
(3) 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
(4) Fe2(SO4)3 + 3BaCl2 → 2FeCl3+ 3BaSO4↓
b) (1) 3NaOH+Fe(NO3)3→3NaNO3+Fe(OH)3↓
(2)2Fe(OH)3 t0 → Fe2O3+3H2O
(3)2Al + Fe2O3 → Al2O3+2Fe
(4)Fe + 2HCl→FeCl2+H2↑
(5) FeCl2 + 2NaOH → 2NaCl + Fe(OH)2

Trước hết, xác định chất tác dụng:
(1): H2O, O2;
(2): CuO (hoặc Cu, Cu(OH)2…);
(3): NaOH hoặc dung dịch kiềm khác;
(4): HNO3; (5): Nhiệt độ; (6): H2, t0 hoặc C, CO; (7): khí clo, t0 hoặc dung dịch muối của kim loại hoạt động kém hơn Cu, hoặc HCl và O2.
Sau đó, lập pthh tương ứng.
Viết phương trình hóa học của các phản ứng thực hiện dãy chuyển hóa:
(1) 4NO2+2H2O+O2→4HNO34NO2+2H2O+O2→4HNO3
(2) 2HNO3+CuO→Cu(NO3)2+H2O2HNO3+CuO→Cu(NO3)2+H2O
(3)Cu(NO3)2+2NaOH→Cu(OH)2↓+2NaNO3Cu(NO3)2+2NaOH→Cu(OH)2↓+2NaNO3
(4)Cu(OH)2+2HNO3→Cu(NO3)2+2H2O
xem tiếp tại: https://cunghocvui.com/bai-viet/bai-5-trang-45-sach-giao-khoa-hoa-11.html

Trích mẫu thử, đánh số. Dùng thuốc thử: nước cho cả hai cặp chất (a), (b)
(a) Mẫu thử hoà tan trong nước là CaO, mẫu thử không tan là CaCO3
(b) Mẫu thử hoà tan trong nước là CaO, mẫu thử không tan là MgO
\(CaO_{ }+H_2O->Ca\left(OH\right)_2\)

+ Các điều kiện phản ứng
(1) Cộng H2O/xt H+ ; (2) oxi hóa, ví dụ bằng CuO ; (3) tác dụng với clo, ở 4500C ; (4) thủy phân trong môi trường bazơ ; (5) oxi hóa, ví dụ bằng CuO.

Bài 2 : Các từ điền vào bài theo thứ tự là :
a ) đối đỉnh
b) đối đỉnh
Bài 3 : Chắc bn bít vẽ r` .
Bài 4 : Tự vẽ hình .B
Xem hình vẽ trên . Góc đối đỉnh vs góc xBy là góc x'By' , ta có : góc x'By' = 600
Bài 5 : a ) Tự vẽ
b) Vẽ tia BC' là tia đối của tia BC . Ta có góc ABC' = 1
800 - 560 = 1240
c)Vẽ tia BA' là tia đối của tia BA . Ta có góc C'BA' = góc CBA ( đối đỉnh ) . Do góc CBA = 560 nên góc C'BA' = 560
Còn lại bn tự lm .
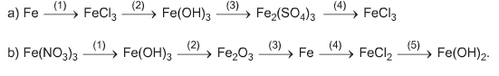
bài này hả bạn
ập phương trình hoá học của các phản ứng sau đây và cho biết trong các phản ứng này, P có tính khử hay tính oxi hoá?
a. P + O2 → P2O5
b. P + Cl2 → PCl3
c. P + S → P2S3
d. P + S → P2S5
e. P + Mg → Mg3P2
f. P + KClO3 → P2O5 + KCl