Cho 13,44 g Cu vào cốc đựng dd 500ml dd AgNO3 0,3M thu được 22,56 g chất rắn và dd B. Tính
Cm của các chất thu được ở dd sau pứ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

+ 1 mol Cu phẳn ứng với 2 mol Ag ----> tăng 152 gam
--x mol ----------------------2x mol---------------9,42 gam
----> nCu = 0,062 mol ; nAg = 0,124 mol
---> n = 0,062 mol ; n = 0,026 mol
----> C_M Cu(NO3) 2 = 0,124 M ; C_M AgNO3 = 0,052 M

Giải thích: Đáp án D
nZn =0,052 > nAgNO3 → dd Z chỉ chứa Zn(NO3)2
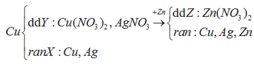
Bảo toàn số mol NO3 thì nZn(NO3)2(Z) =0,02 mol→ rắn T có mZn = 2,925-0,02.65=1,625g
Trong rắn T đặt nCu =x, nAg =y → 64x + 108y=3,217-1,625 = 1,592(g)
Bảo toàn điện tích trong dd Y có 2x + y =0,04 → x =0,018 mol y =0,004 mol
Bảo toàn khối lượng Cu và Ag trong phản ứng td với AgNO3 có
m + 0,04.108=mCu(Y) +mAg(Y) +3,88 → m =0,018.64+0,004.108+3,88-0,04.108=1,152 (g)

Trong dd ban đầu:
K+_____a mol
Mg2+___b mol
Na+____c mol
Cl-_____a + 2b + c mol
mhhbđ = 74.5a + 95b + 58.5c = 24.625 g______(1)
nAgNO3 = 0.3*1.5 = 0.45 mol
Cho Mg vào A có phản ứng (theo gt) nên Ag(+) còn dư, Cl(-) hết. Rắn C gồm Ag và có thể cả Mg còn dư nữa. Thật vậy, khi cho rắn C vào HCl loãng thì khối lượng rắn bị giảm đi, chính do Mg pư, Ag thì không. Vậy mrắn C giảm = mMg chưa pư với A = 1.92 g.
=> nMg dư = 1.92/24 = 0.08 mol
=> nMg pư với A = 2.4/24 - 0.08 = 0.02 mol________(*)
Khi cho Mg vào A có pư:
Mg + 2Ag(+) ---> 2Ag(r) + Mg(2+)
0.02__0.04
=> nAg(+) pư với dd ban đầu = 0.45 - 0.04 = 0.41 mol
Ag(+) + Cl(-) ---> AgCl(r)
0.41___0.41
Có: nCl(-) = a + 2b + c = 0.41_____________(2)
Trong các cation trên, Mg(2+) và Ag(+) có pư với OH(-), tuy nhiên trong D chỉ có Mg(2+) nên kết tủa là Mg(OH)2:
Mg(2+) + 2OH(-) ---> Mg(OH)2
Khi nung:
Mg(OH)2 ---> MgO + H2O
Ta có: nMg(2+)trongD = nMgO = 4/40 = 0.1 mol
Trong đó 0.02 mol Mg(2+) được thêm vào bằng cách cho kim loại Mg vào (theo (*)), vậy còn lại 0.08 mol Mg(2+) là thêm từ đầu, ta có:
b = 0.08 mol_________________________(3)
(1), (2), (3) => a = 0.15, b = 0.08, c = 0.1
mKCl = 74.5*0.15 = 11.175 g
mMgCl2 = 95*0.08 = 7.6 g
mNaCl = 58.5*0.1 = 5.85 g

Cho hỗn hợp (K, Li, Fe) vào dd CuCl2 dư.
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
\(Li+H_2O\rightarrow LiOH+\dfrac{1}{2}H_2\)
\(Fe+CuCl_2\rightarrow FeCl_2+Cu\)
\(CuCl_2+2KOH\rightarrow Cu\left(OH\right)_2+2KCl\)
\(CuCl_2+2LiOH\rightarrow Cu\left(OH\right)_2+2LiCl\)
\(FeCl_2+2KOH\rightarrow Fe\left(OH\right)_2+2KCl\)
\(FeCl_2+2LiOH\rightarrow Fe\left(OH\right)_2+2LiCl\)
\(A:Cu\left(OH\right)_2,Fe\left(OH\right)_2\)
\(B:KCl,LiCl,CuCl_2\)
\(D:H_2\)
Cho dd B pư với dd AgNO3 dư thu được kết tủa E và dd F
\(KCl+AgNO_3\rightarrow KNO_3+AgCl\)
\(LiCl+AgNO_3\rightarrow LiNO_3+AgCl\)
\(CuCl_2+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2AgCl\)
\(E:AgCl\)
\(F:KNO_3,LiNO_3,Cu\left(NO_3\right)_2\)
Cho kết tủa A nung trong không khí đến khối lượng không đổi thu được chất rắn G
\(Cu\left(OH\right)_2\underrightarrow{^{^{t^0}}}CuO+H_2O\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{^{^{t^0}}}2Fe_2O_3+4H_2O\)
\(G:CuO,Fe_2O_3\)
Dẫn khí D qua chất rắn G nung nóng thu được một chất rắn duy nhất.
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
Chổ này có gì nhầm lẫn thì phải , nếu như CuCl2 dư thì lượng Fe sẽ phản ứng hoàn toàn với CuCl2 tạo FeCl2 , nguyên tố Fe đi xuyên suốt đề bài rồi em !

Gọi \(n_{Fe_3O_4}=a\left(mol\right)\rightarrow n_{Cu}=3a\left(mol\right)\)
\(232a+64.3a=21,2\\ \Leftrightarrow a=0,05\left(mol\right)\)
\(m_{HCl}=125.14,6\%=18,25\left(g\right)\)
PTHH:
Fe3O4 + 8HCl ---> FeCl2 + 2FeCl3 + 4H2O
0,05------>0,4------->0,05---->0,1
\(m_X=0,05.3.64=9,6\left(g\right)\)
\(m_{dd}=232.0,05+125=136,6\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{0,05.127}{136,6}.100\%=4,65\%\\C\%_{FeCl_3}=\dfrac{0,1.162,5}{136,6}.100\%=11,9\%\\C\%_{HCl\left(dư\right)}=\dfrac{18,25-0,4.36,5}{136,6}=2,67\%\end{matrix}\right.\)