Câu 2, Cho 58,5g kim loại Y phản ứng với hỗn hợp gồm O2 và N2 có tỉ khối so với H2 là 15,6 . sau phản ứng còn lại 6,72 lít hỗn hợp khí có tỉ khối so với H2 là 15 . Xác định Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi a (mol) và b (mol) lần lượt là số mol khí H2 và khí O2 ban đầu.
Phân tử khối trung bình của hỗn hợp khí thu được sau phản ứng là 14.2=28 (g/mol), hỗn hợp gồm H2O (a mol) và O2 (b-a/2 mol).
18a+32(b-a/2)=(a+b-a/2).28 \(\Rightarrow\) b=3a.
Thành phần phần trăm các khí trong hỗn hợp ban đầu:
%Vkhí hiđro=\(\dfrac{a}{a+b}\).100%=\(\dfrac{a}{5a}\).100%=20%, suy ra %Vkhí oxi=100%-20%=80%.
Xin lỗi! Mình làm sai rồi.
Chữa:
Gọi a (mol) và b (mol) lần lượt là số mol khí H2 và khí O2 ban đầu.
Phân tử khối trung bình của hỗn hợp khí thu được sau phản ứng là 14.2=28 (g/mol), hỗn hợp gồm H2O (a mol) và O2 (b-a/2 mol).
18a+32(b-a/2)=(a+b-a/2).28 ⇒ b=3a.
Thành phần phần trăm các khí trong hỗn hợp ban đầu:
%Vkhí hiđro=\(\dfrac{a}{a+b}\).100%=\(\dfrac{a}{4a}\).100%=25%, suy ra %Vkhí oxi=100%-25%=75%.

Đáp án : A
nX = 0,05 mol ; MX = 38,4g => nO2 = 0,03 ; nO3 = 0,02 mol
2Ag + O3 -> Ag2O + O2
2x <- x -> x (mol)
MY = 33,6g = (1,92 – 16x)/0,05 => x = 0,015 mol
=> a = mAg = 3,24g

\(\overline{M_{bđ}}=15,2.2=30,4\)
\(n_{bđ}=\frac{1,12}{22,4}=0,5\left(mol\right)\)
\(\left\{{}\begin{matrix}n_{O2}:a\left(mol\right)\\n_{N2}:b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,5\\\frac{32a+28b}{0,5}=30,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(\overline{M_{dư}}=30\)
\(n_{O2\left(dư\right)}=x\left(mol\right)\)
\(\Rightarrow\frac{32x+28.0,2}{x+0,2}=30\)
\(\Rightarrow x=0,2\)
\(n_{O2\left(pư\right)}=0,3-0,2=0,1\left(mol\right)\)
\(4Y+O_2\rightarrow2Y_2O\)
0,4____0,1______
\(\Rightarrow M_Y=\frac{15,6}{0,4}=39\left(K\right)\)

ĐÁP ÁN D
Pv=nRt nên n khí sau=9/10 n khí trước
trong hh ban đầu nH2/nN2=4 nến tính theo hiêu suất N2
mất đi 1/10 tức là 2 lần nN2 phản ưng nên nN2 pư bằng 1/20 hh ban đầu
H=1/20 /(1/5)=25%

Đáp án B
![]()
=> hỗn hợp khí gồm CO2 và COdư
BTNT C=> nhh khí = nCO (bđ) = 0,3 (mol)
BTKL ta có: mCO + moxit = mKL + mhh
=> 0,3.28 + 12 = m + 40. 0,3
=> m = 8,4 (g)




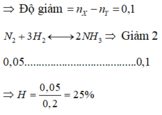
Sau phản ứng , hỗn hợp khí gồm O2(dư) và N2
Gọi nO2(dư)=a(mol);nN2=b(mol)
Ta có :
nkhí= a+b = 6,72/22,4 = 0,3(mol)
mkhí=32a = 28b = 0,3.15.2 = 9(gam
⇒a = 0,15; b = 0,15
Gọi nO2(ban đầu)=a(mol)
Ta có :
mkhí=mO2+mN2
⇒32a+0,15*28=(a+0,15)*15,6*2
⇒a=0,6
⇒nO2(pư)=a−0,15=0,6−0,15=0,45(mol)
Gọi hóa trị của Y là n
4Y+nO2 →2Y2On
Theo phương trình , ta có :
nY=4nNO2=1,8\n(mol)
⇒mY=1,8/n*Y=58,5(gam)
⇒Y=65/2n
Với n=1thì Y=32,5\(loại)
Với n=2 thì Y=65(Zn)
Với n=3 thì Y=97,5(loại)
Vậy Y là kim loại Zn (kẽm)