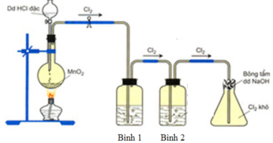
Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl. a) Hãy viết phương trình phản ứng điều chế khí Cl2 (ghi rõ điều kiện). b) Giải thích tác dụng của bình (1) (đựng dung dịch NaCl bão hòa); bình (2) (đựng dung dịch H2SO4 đặc) và nút bông tẩm dung dịch NaOH ở bình (3)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
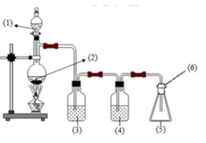
Giải thích sơ đồ thí nghiệm điều chế khí clo sạch trong phòng thí nghiệm:
Phản ứng: M n O 2 + 4 H C L → t ° M n C l 2 + C l 2 ↑ + 2 H 2 O .
Vì dung dịch HCl dùng là đặc nên dễ bay hơi, tách ra khỏi dung dịch tạo khí HCl, H2O khi đun nóng cũng dễ bay hơi nên sản phẩm phản ứng ngoài khí Cl2 thu được còn có lẫn khí HCl và H2O. Vì lẫn khí HCl và H2O nên để thu khí sạch cần bố trí thêm 2 bình (1) và (2) để giữ chúng lại.
Bình (1) dùng dung dịch NaCl nhằm giữ lại khí HCl, đồng thời cũng hạn chế khả năng tan của khí Cl2.
Khí thoát ra bình (2) là Cl2 có lẫn H2O nên bình (2) chứa H2SO4 đặc để giữ H2O lại.
→ khí Cl2 thoát ra khỏi bình (2) được thu ở bình tam giác được nút bằng bông tẩm dung dịch NaOH.
Vì phản ứng: 2NaOH + Cl2 → NaCl + NaClO nên tránh trường hợp khí Cl2 đầy bình thoát ra ngoài.
Xem xét các phát biểu:
(a) đúng. Với MnO2 thì cần đun nóng, còn KMnO4 thì có thể đun nóng hoặc không đun.
(b) sai. Vì nếu đổi thì lúc qua bình (1), khí Cl2 thoát ra có thể lẫn khí H2O → không rửa sạch nữa.
(c) sai. Vì bình (2) không giữ được khí HCl.
(d) đúng.
(e) sai. Vì chất rắn NaCl không giữ được khí HCl, bình (2) cũng không nên khí Cl2 thu ,không sạch.
→ có tất cả (2) phát biểu đúng.

Đáp án A
ó Giải thích sơ đồ thí nghiệm điều chế khí clo sạch trong phòng thí nghiệm:
· Phản ứng:
![]() .
.
ê Vì dung dịch HCl dùng là đặc nên dễ bay hơi, tách ra khỏi dung dịch tạo khí HCl, H2O khi đun nóng cũng dễ bay hơi nên sản phẩm phản ứng ngoài khí Cl2 thu được còn có lẫn khí HCl và H2O.
ê Vì lẫn khí HCl và H2O nên để thu khí sạch cần bố trí thêm 2 bình (1) và (2) để giữ chúng lại.
· Bình (1) dùng dung dịch NaCl nhằm giữ lại khí HCl, đồng thời cũng hạn chế khả năng tan của khí Cl2.
· Khí thoát ra bình (2) là Cl2 có lẫn H2O nên bình (2) chứa H2SO4 đặc để giữ H2O lại.
→ khí Cl2 thoát ra khỏi bình (2) được thu ở bình tam giác được nút bằng bông tẩm dung dịch NaOH.
Vì phản ứng: 2NaOH + Cl2 → NaCl + NaClO nên tránh trường hợp khí Cl2 đầy bình thoát ra ngoài.
Xem xét các phát biểu:
þ (a) đúng. Với MnO2 thì cần đun nóng, còn KMnO4 thì có thể đun nóng hoặc không đun.
ý (b) sai. Vì nếu đổi thì lúc qua bình (1), khí Cl2 thoát ra có thể lẫn khí H2O → không rửa sạch nữa.
ý (c) sai. Vì bình (2) không giữ được khí HCl.
þ (d) đúng.
ý (e) sai. Vì chất rắn NaCl không giữ được khí HCl, bình (2) cũng không nên khí Cl2 thu ,không sạch.
→ có tất cả (2) phát biểu đúng.

Chọn đáp án D.
Dung dịch NaCl hấp thụ hiđroclorua, dung dịch H2SO4 đặc hấp thụ hơi nước, nếu dùng NaOH thì sẽ mất một phần Cl2

Đáp án B
Dẫn khí Cl 2 có lẫn HCl và H 2 O qua bình (1) chứa dung dịch NaCl bão hòa để hấp thụ HCl (do độ tan của HCl lớn hơn Cl 2 ). Cl 2 và H 2 O thoát ra khỏi bình (1) được dẫn qua bình (2) chứa H 2 SO 4 đặc để loại bỏ hơi nước.

Chọn đáp án D
D sai vì nếu thay NaCl bằng KOH thì C l 2 sinh ra sẽ phản ứng với KOH, không thu được khí clo.
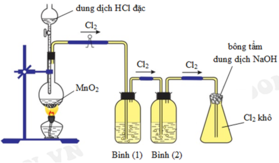

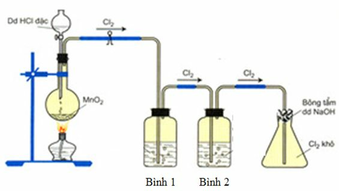
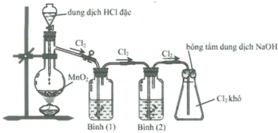
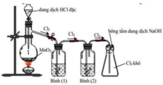
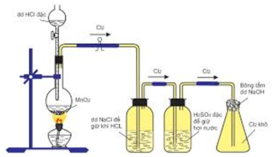




PTHH: \(4HCl_{\left(đ\right)}+MnO_2\xrightarrow[]{t^o}MnCl_2+Cl_2\uparrow+2H_2O\)
- Bình đựng dd NaCl bão hòa để hấp thụ khí HCl
- Bình đựng dd H2SO4 đặc để hút nước
- Bông tẩm NaOH để tránh khí Clo bay ra ngoài
tui chưa gửi hình mà