HH X gồm MgSO4, CuSO4 và Al2(SO4)3 . Phàn trắm khối lượng của nguyên tố lưu huỳnh trong hh X là 24,5525%.
a, Từ 39,1 gam hh X có thể điều chế được tối đa m gam chất rắn Y gồm 3 kim loại Mg, Cu, Al. Tính m ?
b, Đốt cháy hoàn toàn m gam rắn Y cần dùng vừa đủ V lít khí O2 (đktc). Tìm giá trị của V ?

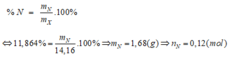
Ta có:
mS = 39,1.24,5525% = 9,6 gam
=> nS = nSO4 = 9,6/32 = 0,3 mol
Ta có:
m = mX−mSO4 = 39,1−0,3.96 = 10,3 gam
Bảo toàn điện tích:
nSO4 = nMg + mCu + 3/2nAl
Đốt cháy Y thu được sản phẩm cháy gồm MgO;CuO;Al2O3
=> nO = nMg + nCu + 3/2nAl = nSO4 = 0,3 mol
=> nO2 = 1/2nO = 0,15 mol
=> VO2 = 0,15.22,4 = 3,36 lít