Hòa tan 9.4g oxit kim loại hóa trị 1 vào nước đc dd A có tính kiềm. Chia A làm 2 phần bằng nhau
P1: cho tác dụng với 95ml dd HCl 1M thấy sau phản ứng còn kiềm dư
P2: cho tác dụng với 105ml dd HCl 1M thấy sau phản ứng còn axit dư
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nM2O=\(\frac{9,4}{2M+16}\) (mol)
- p1 làm quỳ hoá xanh → OH- dư → nOH->nHCl=0,095 (mol)
- p2 làm quỳ hoá đỏ → H+ dư → nHCl>nOH-=0,105 (mol)
\(\Rightarrow0,105\cdot2>\frac{9,4}{2M+16}>0,095\cdot2\)
\(\Leftrightarrow41,474>M>31,14\)
→ M=39 (K) →K2O

Gọi n M 2 O = a thì nMOH = 2a, mỗi phần có nMOH = a
Khi nHCl = 0,095 thì dung dịch sau phản ứng làm quỳ tím hóa xanh nên MOH dư => a > 0,095
Khi nHCl = 0,11 thì dung dịch sau phản ứng làm quỳ tím hóa đỏ nên HCl dư => a < 0,11
Có 0,095 < a < 0,11
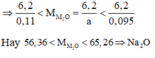
Đáp án B

gọi Oxit kim loại M là A2O
cho M tác dụng với H2O dư được dung dịch A có tính kiềm
PTHH: \(A2O+H2O->2AOH\)(1)
theo phần 1 khi cho dung dịch thu được trong pư(1) tác dụng vs dd HCl (95ml) thấy dung dịch sau pư làm quỳ tím xanh
=>AOH+HCL\(->ACL+H2O\)
ta có \(C\left(HCL\right)=\dfrac{nHCL}{VHCL}=>nHCL=VHCl.C\left(HCL\right)=\dfrac{95}{1000}.1=0,095mol\)
do dung dịch sau pư LÀM quỳ tím háo xanh=>AOH dư
=>nA2O>nHCL=>nA2O>0,095(2)
theo phần 2 vì khi cho dung dịch thu đc sau pư (1) Cho tác dụng với 55ml dung dịch HCl 2M,thấy dung dịch sau phản ứng làm đỏ quỳ tím
=>pthh: AOH+HCL->ACL+H2O
tương tự trên =>\(nHCL=2.\dfrac{55}{1000}=0,11mol\)
vì sau pư thấy dd làm đỏ q tím=>HCL còn dư=>nA2O<nHCL=0,11(3)
từ(2)(3)=>0,095<nA2O<0,01=>\(\dfrac{6,2}{0,095}>\dfrac{6,2}{nA2O}>\dfrac{6,2}{0,11}\)
=>65,2>MA2O>56,3=>MA2O=62(g/mol)=>A là Na=>ct : NA2O
natri oxit
nM2O=9,42\M+169,42M+16 (mol)
- p1 làm quỳ hoá xanh → OH- dư → nOH->nHCl=0,095 (mol)
- p2 làm quỳ hoá đỏ → H+ dư → nHCl>nOH-=0,105 (mol)
⇒0,105⋅2>9,42\M+16>0,095⋅2
⇔41,474>M>31,14⇔41,474>M>31,14
→ M=39 (K) →K2O
Mơn ạ