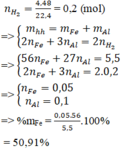Cho 19,3g hỗn hợp gồm Al và Fe tác dụng với dd h2so4 loãng,phản ứng xây ra hoàn toàn thu được 14,65 lít khí H2 (đktc). Tính phần trăm khối lượng của Al và Fe trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Al}=a\left(mol\right)\)
\(n_{Fe}=b\left(mol\right)\)
\(m=27a+56b=19.3\left(g\right)\left(1\right)\)
\(n_{H^+}=0.2\cdot2+0.2\cdot2.25\cdot2=1.3\left(mol\right)\)
\(2Al+6H^+\rightarrow2Al^{3+}+3H_2\)
\(Fe+2H^+\rightarrow Fe^{2+}+H_2\)
\(n_{H^+}=3a+2b=1.3\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.3,b=0.2\)
\(\%Al=\dfrac{0.3\cdot27}{19.3}\cdot100\%=41.96\%\)
\(\%Fe=58.04\%\)
\(b.\)
\(n_{H_2}=\dfrac{1}{2}n_{H^+}=0.65\left(mol\right)\)
Bảo toàn khối lượng :
\(m_{Muối}=19.3+0.4\cdot36.5+0.45\cdot98-0.65\cdot2=76.7\left(g\right)\)

Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 56y = 11 (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo ĐLBT mol e, có: 3x + 2y = 0,4.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

Đáp án A
n H 2 = 0 , 2 ( m o l )
=> mhh= mFe + mAl
Bảo toàn electron:
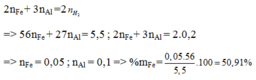

Gọi x, y lần lượt là số mol Al, Fe
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\\ Tacó:\left\{{}\begin{matrix}27x+56y=0,83\\1,5x+y=0,025\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,01\\y=0,01\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{Al}=0,27\left(g\right)\\m_{Fe}=0,56\left(g\right)\end{matrix}\right.\)

a) Sửa đề: dd H2SO4 9,8%
Ta có: \(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\) \(\Rightarrow m_{H_2}=0,35\cdot2=0,7\left(g\right)\)
Bảo toàn nguyên tố: \(n_{H_2SO_4}=n_{H_2}=0,35\left(mol\right)\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,35\cdot98}{9,8\%}=350\left(g\right)\)
\(\Rightarrow m_{dd}=m_{KL}+m_{H_2SO_4}-m_{H_2}=361,6\left(g\right)\)
b) Tương tự câu a

Đáp án A
Đặt nFe = a và nAl = b.
+ Phương trình theo khối lượng hỗn hợp: 56a + 27b = 9,65 (1)
+ Phương trình bảo toàn e là: 2a + 3b = 2nH2 = 0,65 (2)
+ Giải hệ (1) và (2) ⇒ nAl = b = 0,15 mol
⇒ %mAl = 0,15×27/9,65 × 100 ≈ 41,97%