1. Cho m gam KMNO4 tác dụng với dd HCl đặc dư thu đc dd X có chứa 28,07g 2 muối và V lít khí Cl2(đktc). Lượng khí Cl2 sinh ra tác dụng vừa đủ vs 7,5g hỗn hợp kim loại Al và M( có tỉ lệ mol tương ứng là 1:2). Kim loại M là?
A. Mg
B. Ca
C. Fe
D Cu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
Gọi a là mol Cl2 sinh ra
\(n_{KCl}=n_{MnCl2}=2,5a\left(mol\right)\)
\(\Rightarrow74,5.2,5a+126.2,5a=28,07\)
\(\Rightarrow a=0,056\)
Gọi a, 2a là mol Al, M
\(2Al+3Cl_2\rightarrow2AlCl_3\)
\(2M+nCl_2\rightarrow2MCl_n\)
\(\Rightarrow1,5a+na=0,056\)
\(\Rightarrow a=\frac{0,056}{1,5+n}\left(1\right)\)
\(27a+M.2a=7,5\)
\(\Rightarrow a=\frac{7,5}{27+2M}\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow\frac{0,056}{1,5+n}=\frac{7,5}{27+2M}\)
\(\Rightarrow7,5\left(1,5+n\right)=0,056.\left(27+2M\right)\)
Không có n thoả mãn M

Bài 15. Lời giải:
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Theo PTHH : \(n_{KCl}=n_{MnCl_2}=x\)
Khối lượng muối = 28,07 ⇒ \(m_{KCl}+m_{MnCl_2}=28,7\)
⇒ x . 74,5 + x . 126 = 28,07
⇒ x = 0,14 mol
\(\Rightarrow n_{KCl}=n_{MnCl_2}=0,14mol\)
Theo PTHH ⇒ \(n_{Cl_2}=\frac{5}{2}n_{KCl}=\frac{5}{2}.0,14=0,35mol\)
Theo định luật bảo toàn e : \(x.n_M+3n_{Al}=2n_{Cl_2}=0,7mol\)
Có tỉ lệ mol Al : M = 1 : 2 \(\Rightarrow\) nAl = a thì nM = 2a
⇒ 2a.x + a.3 = 0,7 mol
Với x = 1 ⇒ a = 0,175 mol ⇒ m Al = 0,175.27 = 4,725 gam
⇒ mM = 7,5 – 4,725 = 2,775 gam
⇒ \(M_M=\frac{2,775}{0,175.2}=7,9\)(loại)
Với x = 2 ⇒ a = 0,1 mol ⇒ mAl = 27.0,1 = 2,7 gam ⇒ m M = 7,5 – 2,7 = 4,8 gam
\(\Rightarrow M_M=\frac{4,8}{0,1.2}=24\)(Mg, chọn)
Vậy kim loại cần tìm là Mg
Bài 14. Lời giải:
\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\\ n_{Cl_2}=\frac{2,5-1,61}{44,5}=0,02\left(mol\right)\\ C\%_{Cl_2}=\frac{0,02.71}{25}.100\%=5,68\%\)

Trong \(20,4g\) hỗn hợp có: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow65a+56b+27c=20,4\left(1\right)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(BTe:2n_{Zn}+2n_{Fe}+3n_{Al}=2n_{H_2}\)
\(\Rightarrow2a+2b+3c=2\cdot0,45\left(2\right)\)
Trong \(0,2mol\) hhX có \(\left\{{}\begin{matrix}Zn:ka\left(mol\right)\\Fe:kb\left(mol\right)\\Al:kc\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow ka+kb+kc=0,2\)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275mol\)
\(BTe:2n_{Zn}+3n_{Fe}+3n_{Al}=2n_{Cl_2}\)
\(\Rightarrow2ka+3kb+3kc=2\cdot0,275\)
Xét thương:
\(\dfrac{ka+kb+kc}{2ka+3kb+3kc}=\dfrac{0,2}{2\cdot0,275}\Rightarrow\dfrac{a+b+c}{2a+3b+3c}=\dfrac{4}{11}\)
\(\Rightarrow3a-b-c=0\left(3\right)\)
Từ (1), (2), (3)\(\Rightarrow\left\{{}\begin{matrix}a=0,1mol\\b=0,2mol\\c=0,1mol\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Zn}=6,5g\\m_{Fe}=11,2g\\m_{Al}=2,7g\end{matrix}\right.\)

Số OXH của Fe sau khi tác dụng với dung dịch HCl là +2 còn sau khi td với Cl2 là +3
TN1
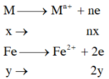
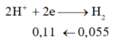
=> nx+2y=0,11 (1)
TN2: Xét cả quá trình
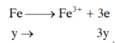
=> nx+3y=0,12 (2)
(1)-(2) được y=0,01
Thay y=0,01 vào (2) được nx=0,09(3)
Lại có: 56.0,01+ xM=1,37
=> Mx=0,81 (4)
(3)(4)=> M=9n
=> Kim loại là Al
Đáp án C

Đáp án : C
X + HCl : Fe -> Fe2+ có nH2 = 0,055 mol
X + Cl2 : Fe -> Fe3+
bảo toàn e : 5nKMnO4 = 2nCl2 => nCl2 = 0,06 mol
Do M có hóa trị không đổi => nFe = ne (2) – ne (1) = 2nCl2 – 2nH2 = 0,01 mol
Giả sử M có hóa trị n => n.nM + 2.0,01 = 2nH2 => n.nM = 0,09 mol
Có : mX = 1,37g = 0,01.56 + nM.M => nM.M = 0,81g
=> M = 9n
Nếu n = 3 => M = 27g (Al) Thỏa mãn

- Theo bài ra \(\Rightarrow\left\{{}\begin{matrix}n_{KMnO_4}=0,1\\n_{KClO_3}=0,15\end{matrix}\right.\) ( mol )
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
.......0,1..........................................................0,25...........
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)
....0,15................................0,45....................
\(\Rightarrow n_{HCl}=0,7\left(mol\right)\)
\(6KOH+3Cl_2\rightarrow KClO_3+5KCl+3H_2O\)
Ta có : \(m=m_{KOH}+m_{Cl_2}=139,3\left(g\right)\)
Vậy ...
Phân số bị lỗi mk chữa lại nha, cái đầu tiên là \(\frac{2,775}{0,175.2}\)
cái thứ hai là \(\frac{4,8}{0,1.2}\)
Học tốt nha
Bn có thể ghi lời giải ra đc k