Người ta đốt cháy lưu huỳnh trong bình chứa khí oxi. Sau phản ứng thu được 19,2 gam khí sunfurơ (SO 2 ) (đktc)
a) Tính số gam lưu huỳnh đã cháy?
b) Tính thể tích khí oxi (đktc) đã phản ứng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài làm
S + O2 ---to---> SO2
a) nSO2 = 19,2 : ( 32 + 32 ) = 0,3 ( mol )
Theo phương trình nS = nSO2 = 0,3 mol
=> mS = 0,3 . 32 = 9,6 ( g )
b) nO2 = 15 : 32 = 0,46875 ( mol )
Xét tỉ lệ: \(\frac{n_{O2}}{1}=0,46875>\frac{n_S}{1}=0,3\)
=> O2 dư, S hết.
=> Bài toán tính theo S.
Theo phương trình:
nO2 = nS = 0,3 ( mol )
=> nO2 sau phản ứng = nO2 ban đầu - nO2 vừa tìm được
Hay nO2 sau phản ứng = 0,46875 - 0,3 = 0,16875 ( mol )
=> mO2 sau phản ứng = 0,16875 . 32 = 5,4 ( g )
# Học tốt #
a) \(PT:S+O_2\rightarrow SO_2\)
\(n_{SO_2}=\frac{m}{M}=\frac{19,2}{64}=0,3\)
\(\)Theo pt: \(n_S=n_{SO_2}=0,3\)
\(\Rightarrow m_s=0,3.32=9,6\)
b, Ta có: \(n_{O_2}=\frac{m}{M}=\frac{15}{32}=0,46875\)
Theo pt: \(n_{O_{2\left(pư\right)}}=n_S=0,3\)
\(\Rightarrow n_{O_{2\left(dư\right)}}=n_{O_2}-n_{O_{2\left(pư\right)}}=0,4875-0,3=0,1875\)
\(\Rightarrow m_{O_{2\left(dư\right)}}=n_{O_{2\left(dư\right)}}.M_{O_2}=0,1875.32=6\)

\(n_{O_2}=\dfrac{15}{32}=0.46875\left(mol\right)\)
\(n_{SO_2}=\dfrac{19.2}{64}=0.3\left(mol\right)\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(0.3...0.3....0.3\)
\(m_S=0.3\cdot32=9.6\left(g\right)\)
\(m_{O_2\left(dư\right)}=\left(0.46875-0.3\right)\cdot32=5.4\left(g\right)\)

S+O2-to>SO2
0,2--0,2----0,2 mol
n SO2=\(\dfrac{4,48}{22,4}\)=0,2 mol
=>m S=0,2.32=6,4g
=>VO2=0,2.22,4=4,48l

\(n_{SO_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(S+O_2\underrightarrow{^{t^0}}SO_2\)
\(n_S=0.1\left(mol\right)\)
\(m_S=0.1\cdot32=3.2\left(g\right)\)
=> A
PTHH : S + O2 -> SO2
nSO2 = V/22,4= 0,1 mol
Theo PTHH : nS = nSO2 = 0,1 mol
=> mS = n.M = 3,2 g

Định luật bảo toàn khối lượng :
\(m_S+m_{O2}=m_{SO2}\)
3,2 + \(m_{O2}\) = 6,4
⇒ \(m_{O2}=6,4-3,2=3,2\left(g\right)\)
Chúc bạn học tốt
\(BTKL: \\ m_S+m_{O_2}=m_{SO_2}\\ 3,2+m_{O_2}=6,4\\ m_{O_2}=6,4-3,2=3,1(g)\)

a) PTHH : \(S+O_2->SO_2\)
b) Ta có : \(n_S\) = \(\dfrac{m_S}{M_S}\) = 0.1 (mol)
Có : \(n_S=n_{O_2}\)
--> \(n_{O_2}\) = 0.1 (mol)
=> \(V_{O_2\left(đktc\right)}\) = \(n_{O_2}\) . 22.4 = 2.24 (L)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\\ PTHH:S+O_2\underrightarrow{t^o}SO_2\\ \left(mol\right)..0,1\rightarrow0,1..0,1\\ V_{O_2}=0,1.22,4=2,24\left(l\right)\)

a) $S + O_2 \xrightarrow{t^o} SO_2$
b)
Theo PTHH :
$n_{O_2} = n_{SO_2} = n_S = \dfrac{3,2}{32} = 0,1(mol)$
$m_{O_2} = 0,1.32 = 3,2(gam)$
$V_{SO_2} = 0,1.22,4 = 2,24(lít)$
Ta có: n S = 3,2 / 32 = 0,1 ( mol )
PTHH: S + O2 \(\rightarrow\) SO2
0,1--0,1-----0,1
Theo pthh
n O2 = 0,1 ( mol ) => m O2 = 3,2 ( g )
n SO2 = 0,1 ( mol ) => V SO2 = 2,24 ( lít )

a, \(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: S + O2 ----to----> SO2
Mol: 0,2 0,2 0,2
b, \(m_{SO_2}=0,2.64=12,8\left(g\right)\)
c, \(V_{O_2}=0,2.22,4=4,48\left(l\right)\)
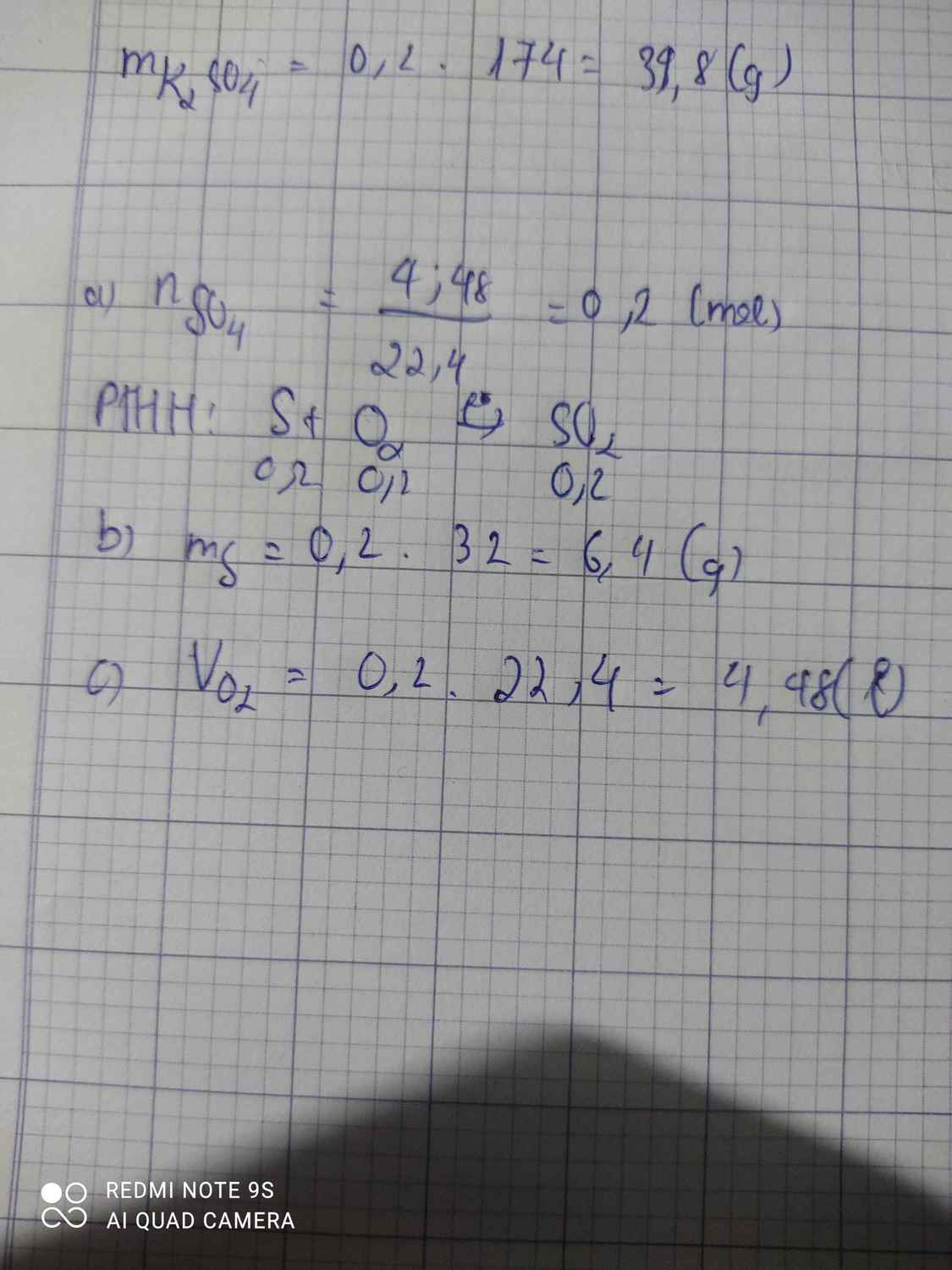
S+O2-to->SO2
0,3---0,3------0,3
nSO2=19,2\64=0,3
=>mS=0,3.32=9,6g
=>VO2=0,3.22,4=6,72l